题目内容
18.原子序数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列有关X的说法中不正确的是( )| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X可能形成化学式为KXO3的含氧酸钾盐 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X能与某些金属元素形成离子化合物 |
分析 原子序数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,X为N元素,符合题意;n=3时,最外层电子数为7,质子数为17,X为Cl元素,符合题意,以此来解答.
解答 解:原子序数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,X为N元素,符合题意;n=3时,最外层电子数为7,质子数为17,X为Cl元素,符合题意.
A.最外层电子数为2n+1,原子核内质子数是2n2-1,根据奇偶性可知,X原子的最外层电子数和核电荷数肯定为奇数,故A正确;
B.元素X可能为氮元素或氯元素,可形成KNO3或KClO3,故B正确;
C.由于元素X可能为氮元素或氯元素,因此不可能形成X(OH)3的碱,故C错误;
D.N元素能与金属Mg元素形成化合物Mg3N2,Cl元素能与金属Na元素形成化合物NaCl,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,关键是根据核外电子排布规律推断元素,难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n | |
| B. | △S>0的反应在一定条件下一定可以自发进行 | |
| C. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| D. | 工业合成SO3不采用高压是因为增大压强对SO2的转化率影响不大 |
9.0.1mol Na2SO4 溶液中钠离子的数目是( )
| A. | 6.02×1023 | B. | 2 | C. | 1.204×1023 | D. | 6.02×1022 |
10.CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
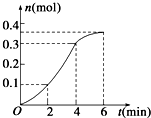

| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
7.某实验需要0.2mol NaOH固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
| A. | 等于8.0 g | B. | 等于8.00 g | C. | 大于8.0 g | D. | 等于0.2 g |
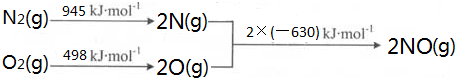
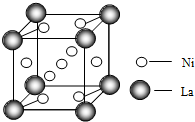 镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛.
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛.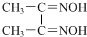 ═
═ +2H+
+2H+