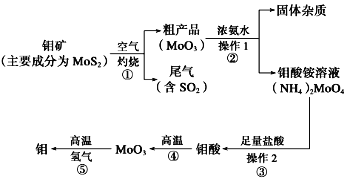
题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol–1
2SO3(g) ΔH=196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol–1
2NO2(g) ΔH=113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
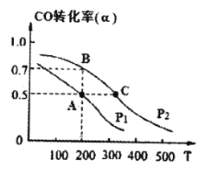
A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
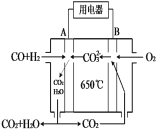
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
【答案】(1)① NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol–1(2分)②bd(2分)
SO3(g)+NO(g) ΔH=-41.8kJ·mol–1(2分)②bd(2分)
(2)① 0.1mol·L-1·min-1 (2分)②cd (2分)(3)①>(1分)②1(1分)<(1分)
(4)负(1分)O2 + 4e-+2CO2 = 2CO32-(2分)
【解析】
试题分析:(1)①根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g)![]() SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1。
SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.反应前后体积不变,所以压强不变,a错误; b.颜色深浅和浓度有关系,所以混合气体颜色保持不变说明反应达到平衡状态,b正确;c.SO3和NO的体积比始终保持1:1不变,不能说明反应达到平衡状态,c错误;d.每消耗1 mol SO2的同时生成1 molNO2,二者的反应速率的方向相反,且满足速率之比是相应的化学计量数之比,说明反应达到平衡状态,d正确,答案选bd。
(2)① 2min时测得生成CH3OH 0.2mol,则消耗氢气是0.4mol,所以0~2min的平均反应速率v(H2)=![]() 0.1mol·L-1·min-1 。
0.1mol·L-1·min-1 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,压强增大,平衡向正反应方向进行,a.c(H2)增大,a错误;b.正、逆反应速率均加快,b错误;c.CH3OH 的物质的量增加,c正确; d.重新平衡c(H2)/c(CH3OH)减小,d正确,答案选cd。
(3)①温度越高,反应速率越快,到达平衡的时间越少,则A、C两点到达平衡状态所需的时间tA>tC。
② CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初起浓度(mol/L) 1 2 0
变化浓度(mol/L) 0.5 1 0.5
平衡浓度(mol/L) 0.5 1 0.5
故K=![]() =1
=1
升高温度转化率降低,说明平衡向逆反应方向进行,所以平衡常数减小,即C点的平衡常数KC<KB。
(4)A电解通入燃料,所以A为电池的负极。正极是氧气得到电子,则B极电极反应式为O2 + 4e-+2CO2 = 2CO32-。

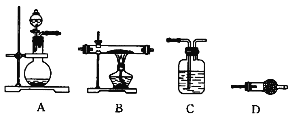
【题目】利用如图所示装置分别盛放相应物质进行下列实验,得出结论正确的是

选项 | ① | ② | ③ | 判定结论 |
A | 浓硫酸 | 蔗糖 | 溴水 | 用来判定浓硫酸具有脱水性、氧化性 |
B | 稀盐酸 | Na2SO3 | Ba(NO3)2 | 用来判定SO2与可溶性钡盐均可生成白色沉淀 |
C | 浓盐酸 | Na2CO3 | Na2SiO3 | 用来判定酸性:盐酸>碳酸>硅酸 |
D | 浓硫酸 | Cu | NaOH | 用来判定制备SO2并吸收尾气 |
A. A B. B C. C D. D
【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
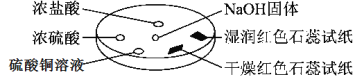
下表中对实验现象所做的解释不正确的是:
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应产生了NH4Cl固体 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 |
D | 硫酸铜溶液变浑浊 | 生成Cu(OH)2沉淀 |
A. A B. B C. C D. D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D