题目内容
12.乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产.回答下列问题:(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式CH2=CH2+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:
甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9KJ•mol-1
甲醇制烯烃反应②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1KJ•mol-1
乙醇异构化反应③CH3CH2OH(g)═CH3OCH3(g)?△H3=+50.7KJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的?△H=-45.5KJ•mol-1
与间接水合法相比,气相直接水合法的优点是:无副产品,原子利用率100%.
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+
6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol,在一定压强下,测得该反应的实验数据如下表.
| 温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量不变(填“增大”、“减小”或“不变”).
③增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,则生成乙醇的物质的量不能确定(填“增大”、“减小”、“不变”或“不能确定”).
分析 (1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),效仿乙酸乙酯水解,将水分成氢原子和羟基生成乙醇和硫酸;
(2)甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ•mol-1
甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ•mol-1
乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol-1,
根据盖斯定律①-②-③计算可得;
气相直接水合法原子利用率100%;
(3)①依据图表数据分析二氧化碳转化率随温度升高减小,结合平衡移动原理得到反应能量变化;
②催化剂对化学平衡没有影响,所以加入催化剂,平衡不移动,反应反应热不变;
③氢气和二氧化碳物质的量比值增大,可以是增加氢气,也可能为减小二氧化碳,所以二氧化碳转化率增大,但生成的乙醇的物质的量不一定增大或减小.
解答 解:(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),化学方程式为C2H4+H2SO4=C2H5OSO3H,硫酸氢乙酯水解生成乙醇和硫酸,化学方程式为C2H5OSO3H+H2O→C2H5OH+H2SO4,
故答案为:C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4;
(2)已知:甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ•mol-1
甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ•mol-1
乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol-1,
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol;
乙烯直接水化法中反应物中所有原子全部都变成生成物,所以原子利用率100%,没有副产品,
故答案为:-45.5;无副产品,原子利用率100%;
(3)①由图表分析判断,随温度升高,二氧化碳转化率减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,a小于0故;故答案为:小于;
②催化剂对化学平衡没有影响,所以加入催化剂,平衡不移动,反应反应热不变,故答案为:不变;
③氢气和二氧化碳物质的量比值增大,可以是增加氢气,也可能为减小二氧化碳,所以二氧化碳转化率增大,但生成的乙醇的物质的量不一定增大或减小,故答案为:不能确定.
点评 本题考查了化学方程式的书写、压强对平衡移动的影响、物质制取方案的比较、反应热及平衡常数的计算等知识,综合性非常强,该题是高考中的常见题型,属于中等难度较大,侧重于学生分析问题、解决问题、知识迁移能力的培养.

| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
| A. | 100mL量筒、烧杯、玻璃棒 | B. | 托盘天平、500mL容量瓶 | ||
| C. | 酒精灯、三角漏斗、导管 | D. | 胶头滴管、玻璃棒、烧杯 |
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 乙烷和丙烯 |
| A. | 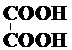 ? ? | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
| A. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| B. | 重结晶法提纯苯甲酸时,为了除去杂质和防止苯甲酸析出,应该趁热过滤 | |
| C. | 配制银氨溶液时,将硝酸银溶液慢慢滴入稀氨水中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| D. | 无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
| A. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA | |
| B. | 100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1molNa2O2中含有的离子数为0.4NA |
