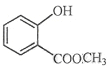
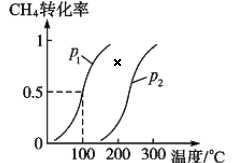
��Ŀ����
����Ŀ����3.2gCu��������Ũ�����ڼ��������³�ַ�Ӧ��
��1���ѷ�Ӧ�����Һϡ����500mL��ȡ��50mL�������м���������![]() ��Һ,�õ�����2.33g����ϡ�ͺ�������Һ��
��Һ,�õ�����2.33g����ϡ�ͺ�������Һ��![]() �����ʵ���Ũ��Ϊ__________��
�����ʵ���Ũ��Ϊ__________��
��2���Ѳ��������建��ͨ��100mL a![]() ��NaOH��Һ�У�����Ӧ�����ʣ�࣬��a��ȡֵ��Χ��____________��
��NaOH��Һ�У�����Ӧ�����ʣ�࣬��a��ȡֵ��Χ��____________��
��3����Ũ�����к�����b mol��Ͷ��������ͭƬ�����ȣ���ַ�Ӧ����ԭ����������ʵ���n(![]() )_________0.5b mol(����>����<������=��)��ԭ����_____________________________
)_________0.5b mol(����>����<������=��)��ԭ����_____________________________
���𰸡�0.2 mol/L 0.5 ��a �� 1 �� �淴Ӧ���У�����Ũ�ȱ�С��ϡ�����ͭ��Ӧ
��������
���⿼��ͭ��Ũ���ᷴӦ����1����������BaCl2��Һ���г�������������Ba2����SO42��=BaSO4����BaSO4������Ϊ2.33g������SO42�������ʵ���Ϊ2.33/233mol=0.01mol����c(SO42��)=0.01/50��10��3mol��L��1=0.2mol��L��1����500mL����Һc(SO42��)=0.2mol��L��1����2��ͭ��������Ũ���ᷴӦ��Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O������SO2�����ʵ���Ϊ3.2/64mol=0.05mol��SO2��NaOH��Ӧ����Ӧ�����ʣ�࣬����������Na2SO3��NaHSO3��Na2SO3��NaHSO3�Ļ�������ȫ�����ɵ���Na2SO3������100��10��3��a=2��0.05����a=1������ȫ��ΪNaHSO3������100��10��3��a=0.05����a=0.5���ó�a�ķ�Χ��0.5 ��a �� 1����3��ͭ��Ũ���ᷢ����Cu��2H2SO4(Ũ)
CuSO4��SO2����2H2O������SO2�����ʵ���Ϊ3.2/64mol=0.05mol��SO2��NaOH��Ӧ����Ӧ�����ʣ�࣬����������Na2SO3��NaHSO3��Na2SO3��NaHSO3�Ļ�������ȫ�����ɵ���Na2SO3������100��10��3��a=2��0.05����a=1������ȫ��ΪNaHSO3������100��10��3��a=0.05����a=0.5���ó�a�ķ�Χ��0.5 ��a �� 1����3��ͭ��Ũ���ᷢ����Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O��������ȫ���μӷ�Ӧ������ԭ����������ʵ���Ϊ0.5b��ֻͭ��Ũ���ᷢ����Ӧ������ϡ���ᷢ����Ӧ�����ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ�ת��Ϊϡ����ʱ����Ӧ��ֹͣ����˱���ԭ����������ʵ���<0.5b��
CuSO4��SO2����2H2O��������ȫ���μӷ�Ӧ������ԭ����������ʵ���Ϊ0.5b��ֻͭ��Ũ���ᷢ����Ӧ������ϡ���ᷢ����Ӧ�����ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ�ת��Ϊϡ����ʱ����Ӧ��ֹͣ����˱���ԭ����������ʵ���<0.5b��