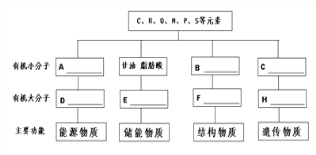
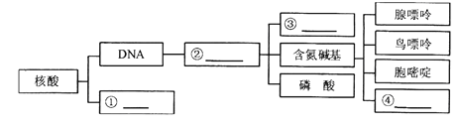
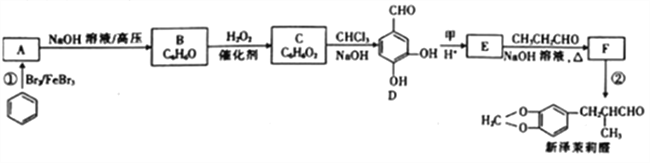
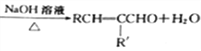题目内容
【题目】按要求,完成下列各小题
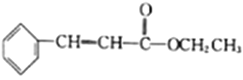
(1)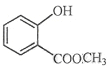 中含有的官能团的名称为__________________________。
中含有的官能团的名称为__________________________。
(2)1,4-二甲苯的结构简式________________________________________。
(3)有机物CH3CH(C2H5)CH(CH3)2的名称是________________________。
(4)![]() 的分子式________________;名称是____________________。
的分子式________________;名称是____________________。
【答案】 羟基 酯基 ![]() 2,3-二甲基戊烷 C7H14 3,3-二甲基-1-戊烯
2,3-二甲基戊烷 C7H14 3,3-二甲基-1-戊烯
【解析】(1)由结构简式可知,分子中含OH、COOC,名称为酚羟基、酯基,故答案为:酚羟基、酯基。
(2)1,4-二甲苯中两个甲基位于对位的位置,故答案为![]() ;
;
(3)根据该有机物的结构简式可知,按系统命名法命名的名称是2,3—二甲基戊烷。
(4)![]() 的结构简式为CH3CH2C(CH3)2CH=CH2,分子式为C7H14,根据系统命名法主链为戊烯,双键在1号C上,在3号C上连有两个甲基,故名称是3,3-二甲基-1-戊烯。
的结构简式为CH3CH2C(CH3)2CH=CH2,分子式为C7H14,根据系统命名法主链为戊烯,双键在1号C上,在3号C上连有两个甲基,故名称是3,3-二甲基-1-戊烯。

 阅读快车系列答案
阅读快车系列答案【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
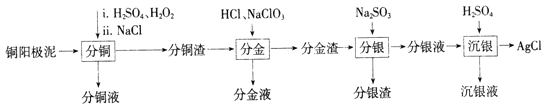
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
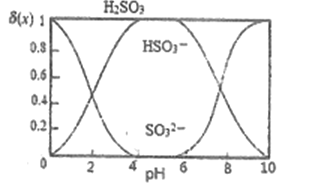
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)