题目内容
【题目】某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。
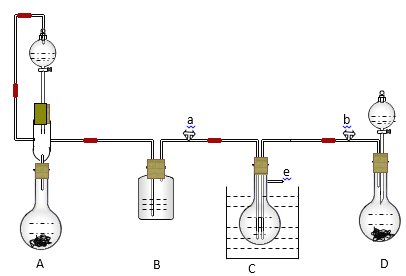
(1)在A中分液漏斗和烧瓶中加入的试剂分别是________、_________;D中分液漏斗和烧瓶中加入的试剂分别为______、________;
(2) B中加入的试剂是______________, 作用是________________________________。
(3)写出C中生成的NaHCO3化学方程式:____________________________________________。
(4)装置A中分液漏斗上方装一导管的主要作用是____________________________________。
(5)实验开始a、b两活塞的正确操作应是(选填序号)_______。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是____________________。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、_____。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,改进的方法是___________。
【答案】盐酸 石灰石 浓氨水 生石灰 碳酸氢钠溶液 除去氯化氢气体 NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl 防止分液漏斗中挥发出的HCl逸出且使溶液容易滴下 ③ 取少量溶液加入氯化钡溶液若没有白色沉淀产生,说明是NaHCO3 灼烧 将尾气循环利用(或通入饱和食盐水中)
【解析】
A为用大理石和盐酸制取二氧化碳的装置,D为用浓氨水和生石灰制取氨气的装置,A中盐酸具有挥发性,B中用饱和碳酸氢钠溶液除去氯化氢气体,在C中,NaHCO3溶解度较小,通过复分解反应制取,NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl。
(1)A为用大理石和盐酸制取二氧化碳的装置,在A中分液漏斗和烧瓶中加入的试剂分别是盐酸、石灰石;D为用浓氨水和生石灰制取氨气的装置,D中分液漏斗和烧瓶中加入的试剂分别为浓氨水、生石灰;
故答案为:盐酸;石灰石;浓氨水;生石灰;
(2)A中盐酸具有挥发性,B中用饱和碳酸氢钠溶液除去氯化氢气体,B中加入的试剂是碳酸氢钠溶液,作用是除去氯化氢气体。
故答案为:碳酸氢钠溶液;除去氯化氢气体;
(3)在C中,NaHCO3溶解度较小,通过复分解反应制取,C中生成的NaHCO3化学方程式:NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl。
故答案为:NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl;
(4)装置A中分液漏斗上方装一导管的主要作用是:平衡分液漏斗上下气压,防止分液漏斗中挥发出的HCl逸出,且使溶液容易滴下。
故答案为:防止分液漏斗中挥发出的HCl逸出,且使溶液容易滴下;
(5)氨气的溶解度大,氨饱和后再通入二氧化碳才能生成NaHCO3的饱和溶液,获得NaHCO3晶体沉淀,实验开始a、b两活塞的正确操作应是先打开b,后打开a;
故答案为:③;
(6)利用碳酸钡难溶,而碳酸氢钡易溶的性质,检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是:取少量溶液加入氯化钡溶液若没有白色沉淀产生,说明是NaHCO3。
故答案为:取少量溶液加入氯化钡溶液若没有白色沉淀产生,说明是NaHCO3 ;
(7)NaHCO3加热分解生成Na2CO3、水和二氧化碳,由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、灼烧。
故答案为:灼烧;
(8)NaHCO3加热分解生成Na2CO3、水和二氧化碳,从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,改进的方法是将尾气循环利用(或通入饱和食盐水中)。
故答案为:将尾气循环利用(或通入饱和食盐水中)。

 灵星计算小达人系列答案
灵星计算小达人系列答案