题目内容
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH (g)。
CH3OH (g)。
(1)该反应的平衡常数表达式为:K=______________________
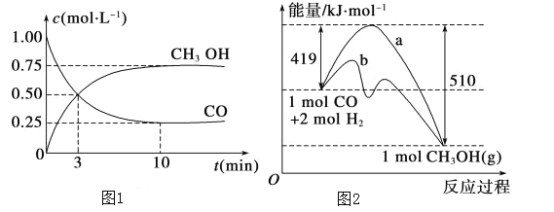
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)=____________。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是________(填“吸热”或“放热”)反应,反应的热化学方程式是__________________________________________。
(4)适宜的催化剂能_______(选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有________(选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
【答案】K= ![]() 0.075mol·L-1·min-1 放热 CO (g)+2H2 (g)
0.075mol·L-1·min-1 放热 CO (g)+2H2 (g) ![]() CH3OH (g) △H=-91kJ·mol-1 b. c c
CH3OH (g) △H=-91kJ·mol-1 b. c c
【解析】
(1)根据平衡常数的定义写出CO (g)+2H2 (g)![]() CH3OH (g),反应的平衡常数表达式为:K=
CH3OH (g),反应的平衡常数表达式为:K=![]() ;
;
(2)根据题列三段式,再结合v=浓度的变化量与时间的变化量比值进行计算;
(3)根据图可知,1molCO和2molH2生成1molCH3OH能量减少(510-419)kJ,据此书写;
(4)根据催化剂的作用分析,催化剂可以加快反应速率,但不影响平衡移动;;
(5)根据影响化学平衡的因素分析;
(1)根据平衡常数的定义:CO (g)+2H2 (g)![]() CH3OH (g),反应的平衡常数表达式为:K=
CH3OH (g),反应的平衡常数表达式为:K=![]() ;
;
故答案为:![]() ;
;
(2)列三段式:
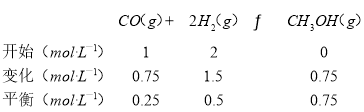
从反应开始到平衡,CO的平均反应速率v(CO)=![]() =0.075 mol·L-1·min-1;
=0.075 mol·L-1·min-1;
故答案为:0.075mol·L-1·min-1;
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。根据图可知,1molCO和2molH2生成1molCH3OH能量减少(510-419)kJ,是放热反应,故其热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91kJ·mol-1;
故答案为:放热;CO(g)+2H2(g)=CH3OH(g)△H=-91kJ·mol-1;
(4)适宜的催化剂:a.不改变反应的热效应,故不选; b.降低反应所需活化能,降低生产能耗 ,故选;c.加快反应速率,缩短反应时间,故选; d.不能改变平衡,不能提高反应物的转化率,故不选;故选b. c;
(5)a.升高温度,平衡向着逆方向移动,则![]() 减小,故a错误;
减小,故a错误;
b.使用催化剂,催化剂不影响化学平衡,则![]() 不变,故b错误;
不变,故b错误;
c.再充入2molH2,反应物浓度增大,平衡正向移动,则![]() 增大,故c正确;
增大,故c正确;
故选c。