��Ŀ����
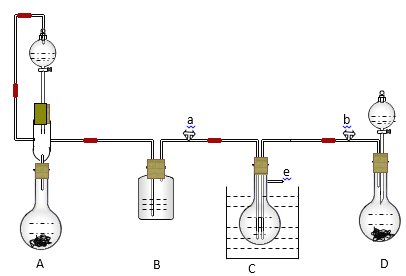
����Ŀ��ClO2��һ�ֹ����Ϲ��ϵİ�ȫ������ɫˮ��������ClO2�ױ�ը��������������������ϡ��ʱ����ը�����͡�ij��ѧС������ͼ��ʾװ���Ʊ�ClO2��������ˮ���ش��������⣺
(1)����A��������__________��Cװ�õ�����Ϊ__________��
(2)װ��B�з�����Ӧ�����ӷ���ʽΪ______________________________��ѡ�������Լ��Ʊ�ClO2���ŵ���______________________________��

(3)ClO2���빤ҵ��ˮ��CN����Ӧ���ɶԴ�������Ⱦ�����壬�÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ__________��
(4)��ͬѧ��Ϊװ��B��Ӧ�����Һ�п��ܴ���Cl���������ʵ����֤����Ҫд�������Լ���ʵ�����������ͽ���(��֪AgClO3������ˮ)______________________________________��
(5)��������Ҳ�ɲ��õ�ⷨ������4ClO3����2H2O![]() 4ClO2����O2����4OH����д����������������Ӧ����ʽΪ__________________________________________��
4ClO2����O2����4OH����д����������������Ӧ����ʽΪ__________________________________________��
���𰸡����������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���� ��ȫƿ�������� H2C2O4 + 2ClO3�� + 2H+= 2CO2�� + 2ClO2�� + 2H2O ����ClO2��ͬʱ������CO2��CO2��ϡ��ClO2����ͱ�ը�Ŀ����� 1��1 ȡ����Bװ�÷�Ӧ�����Һ���Թ��У������������ᱵ��Һ������ַ�Ӧ���ã�ȡ�ϲ���Һ���Թ��У����������ữ����������Һ���۲��Ƿ��а�ɫ�������������У������Cl�������ޣ�����Cl���� ClO3��+e��= ClO2��+2OH��
��������
����װ��ͼ�ɵã�AΪ��Һ©����������Һ��Ϳ������٣�CΪ��ȫƿ����������Bװ��Ϊ�Ʊ�ClO2װ�ã������������������CO2��ClO2������������ԭ��ʧ�����غ�ɵ÷���ʽ��ClO2����CN������CO2��N2�����ݵ�ʧ�������������ͻ�ԭ�����ʵ���֮�ȣ�װ��B���������ʣ�࣬��Ҫ����Cl�������ȳ�ȥ����������ټ��飻���ʱ����������ԭ��Ӧ�������ܷ�Ӧ�ɵõ缫ʽ���ݴ˷�����
(1)����װ��ͼ��֪��AΪ��Һ©��������Ϊ���������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���ʣ�����Cװ�ý����ܡ������ܾ��϶̿�֪��CΪ��ȫƿ������������Ϊ�����������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���ʣ���ȫƿ����������
(2)Bװ��Ϊ�Ʊ�ClO2װ�ã������������������CO2��ClO2������������ԭ��ʧ�����غ�ɵ÷���ʽ��H2C2O4 + 2ClO3��+ 2H+= 2CO2�� + 2ClO2�� + 2H2O��ClO2�ױ�ը��������������������ϡ��ʱ����ը�����ͣ�����CO2Ϊ�����壬�����ŵ�������CO2��ϡ��ClO2����ͱ�ը�Ŀ����ԣ���Ϊ��H2C2O4 + 2ClO3��+ 2H+= 2CO2�� + 2ClO2�� + 2H2O������ClO2��ͬʱ������CO2��CO2��ϡ��ClO2����ͱ�ը�Ŀ����ԣ�
(3)ClO2���빤ҵ��ˮ��CN����Ӧ���ɶԴ�������Ⱦ�����壬������CO2��N2���÷�Ӧ����������ClO2������ԭΪCl����ÿĦ�����������ϼ۽���5�ۣ���ԭ����CN��,����������CO2��N2��ÿĦ����ԭ�����ϼ�����5�ۣ����ʵ���֮��Ϊ1��1����Ϊ��1��1��
(4)װ��B���������ʣ�࣬��Ҫ����Cl�������ȳ�ȥ����������ټ��飻��Ϊ��ȡ����Bװ�÷�Ӧ�����Һ���Թ��У������������ᱵ��Һ������ַ�Ӧ���ã�ȡ�ϲ���Һ���Թ��У����������ữ����������Һ���۲��Ƿ��а�ɫ�������������У������Cl�������ޣ�����Cl����
(5)���ʱ����������ԭ��Ӧ�������ܷ�Ӧ4ClO3����2H2O![]() 4ClO2����O2����4OH���õ缫ʽΪ��ClO3��+e��= ClO2��+2OH������Ϊ��ClO3��+e��= ClO2��+2OH����
4ClO2����O2����4OH���õ缫ʽΪ��ClO3��+e��= ClO2��+2OH������Ϊ��ClO3��+e��= ClO2��+2OH����