题目内容
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O能否反应产生Cl2。
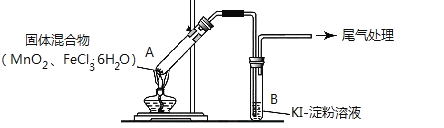
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(1)实验1和实验2产生白雾的原因是___________________________。
(2)实验2说明黄色气体中含有___________(填化学式)则实验1中③的现象也可能是发生了另一个离子反应,则其离子方程式为______________________________。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B 间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是_________________;方案2中检验 Fe2+的试剂名称是____________,选择NaBr溶液的依据是__________________。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________。请你设计实验方案验证此猜想__________________________。
【答案】 FeCl36H2O受热失去结晶水,FeCl3水解生成HCl气体,HCl和H2O结合形成盐酸小液滴 FeCl3 2Fe3++2I-=2Fe2++I2 饱和NaCl溶液 铁氰化钾溶液 Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2 MnO2+2FeCl3·6H2O![]() Fe2O3+MnCl2+Cl2↑+2HCl+11H2O 实验未先赶出空气,其中的O2在此条件下可能氧化I- 向一试管中加入KI淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝
Fe2O3+MnCl2+Cl2↑+2HCl+11H2O 实验未先赶出空气,其中的O2在此条件下可能氧化I- 向一试管中加入KI淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝
【解析】(1)FeCl36H2O受热失去结晶水,同时水解,生成HCl气体,HCl和H2O结合形成盐酸小液滴;
(2)根据铁离子与KSCN反应的实验现象判断;根据FeCl3具有氧化性分析;
(3)根据氯气中含有的杂质分析;根据检验Fe2+的试剂是铁氰化钾溶液以及Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2分析;
(4)结合电子守恒、原子守恒书写化学方程式;
(5)根据酸性条件下空气中的氧气也可能氧化碘离子生成碘单质分析解答。
(1)FeCl36H2O受热失去结晶水FeCl36H2O![]() FeCl3+6H2O,同时水解FeCl3+3H2O
FeCl3+6H2O,同时水解FeCl3+3H2O![]() Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;
Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;
(2)A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红,说明黄色气体是氯化铁;碘离子具有还原性,氯化铁具有强氧化性,两者反应,碘离子被氧化为碘单质使KI淀粉溶液变蓝,反应的离子方程式为2Fe3++2I-=2Fe2++I2;
(3)方案1:除去Cl2中的FeCl3和O2(H+),若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在Cl2,Cl2中的氯化氢的去除使用饱和NaCl溶液,饱和NaCl溶液也可以让FeCl3溶解,并且除去O2影响过程中提供酸性的HCl气体,从而排除两个其他影响因素;方案2:观察到A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红,说明生成铁离子,方案2中检验Fe2+的试剂是铁氰化钾溶液,遇到亚铁离子生成蓝色沉淀,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2;
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则生成物中氯气和氯离子物质的量之比为1:4,反应中锰元素化合价+4价变化为+2价,氯元素化合价-1价变化为0价,根据电子守恒和原子守恒得到A中发生反应的化学方程式为MnO2+2FeCl3·6H2O![]() Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;
Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-,FeCl36H2O受热水解,生成HCl气体,作对照实验,需用盐酸酸化,即另取一支试管,向其中加入KI淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝,若一段时间后溶液变蓝则推测成立。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案