题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡都是重要的化学平衡。已知H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-。下列说法正确的是( )
H++A2-。下列说法正确的是( )
A.0.01mol·L-1H2A溶液的pH等于2
B.稀释NaHA溶液,溶液中所有离子浓度均减小
C.Na2A溶液呈中性
D.Na2A溶液中水的电离度大于等浓度NaHA溶液中水的电离度
【答案】D
【解析】
A.0.01mol·L-1H2A溶液缺少第二步电离平衡常数Ka,pH无法计算,A错误;
B. NaHA溶液呈酸性稀释时,其c(H+)减小,因温度不变,KW不变,故c(OH-)增大,B错误;
C. Na2A溶液中A2-水解,溶液呈碱性,C错误;
D.Na2A溶液中A2-水解,水的电离受促进,NaHA溶液中HA-电离,水的电离度收到抑制。Na2A溶液中水的电离度大于等浓度NaHA溶液中水的电离度,D正确;
答案选D。

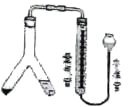
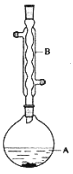
【题目】乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
![]() +H2O
+H2O
相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)装置B的名称是:___。
(2)该反应中浓硫酸的作用___,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式___。
(3)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作___。
(4)在洗涤操作中,第一次水洗的主要目的是:___;第二次水洗的主要目的是:___。
(5)本实验中加入过量乙酸的目的是:___。
(6)在蒸馏操作中,仪器选择及安装都正确的是:___(填标号)
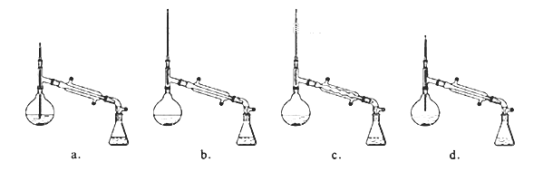
(7)本实验的产率是___。
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏___(填高或者低)原因是___。