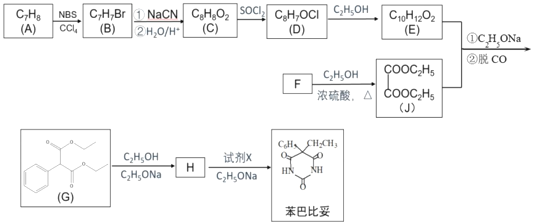
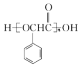
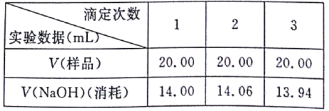
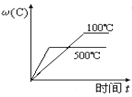
题目内容
【题目】下列有关化学平衡的描述,不正确的是( )
A.向反应体系Cl2(aq)+H2O(l)![]() HCl(aq)+HClO(aq)中加入NaOH溶液,颜色变浅
HCl(aq)+HClO(aq)中加入NaOH溶液,颜色变浅
B.恒容条件下,升高反应体系2NO2(g)![]() N2O4(g) △H<0的温度,颜色变深
N2O4(g) △H<0的温度,颜色变深
C.一定温度下,向体积不变的反应体系2HI(g)![]() H2(g)+I2(g)中加入HI,颜色变深
H2(g)+I2(g)中加入HI,颜色变深
D.一定温度下,向体积不变的反应体系CaCO3(s)![]() CaO(s)+CO2(g)中通入CO2,平衡后c(CO2)增大
CaO(s)+CO2(g)中通入CO2,平衡后c(CO2)增大
【答案】D
【解析】
A.向反应体系Cl2(aq)+H2O(l)![]() HCl(aq)+HClO(aq)中加入NaOH溶液,平衡正向移动,颜色变浅, A正确;
HCl(aq)+HClO(aq)中加入NaOH溶液,平衡正向移动,颜色变浅, A正确;
B.容条件下,升高反应体系2NO2(g)![]() N2O4(g) △H<0的温度,平衡向吸热反应方向移动逆向移动,所以颜色变深,B正确;
N2O4(g) △H<0的温度,平衡向吸热反应方向移动逆向移动,所以颜色变深,B正确;
C.一定温度下,向体积不变的反应体系2HI(g)![]() H2(g)+I2(g)中加入HI,I2浓度变大颜色变深,C正确;
H2(g)+I2(g)中加入HI,I2浓度变大颜色变深,C正确;
D.一定温度下,向体积不变的反应体系CaCO3(s)![]() CaO(s)+CO2(g)中通入CO2,由于平衡常数K=c(CO2),温度不变,平衡常数不变,则平衡后c(CO2)不变,D错误;
CaO(s)+CO2(g)中通入CO2,由于平衡常数K=c(CO2),温度不变,平衡常数不变,则平衡后c(CO2)不变,D错误;
答案选D。

 名校课堂系列答案
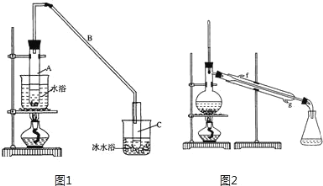
名校课堂系列答案【题目】某化学小组采用如图装置,以环己醇制备环己烯:
已知: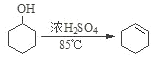 +H2O
+H2O
密度(g/cm3) | 熔点(℃) | 沸点(℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知:温度高于100℃时,原料环己醇易和水形成共沸物一起被蒸出反应体系。
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①如图1导管B的作用是______。
②加热试管A采用热水浴,而非直接加热,目的是______,试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等,加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.溴水或溴的四氯化碳溶液
②再将环己烯按图2装置蒸馏,冷却水从______口进入(填“上”或“下”)。
③收集产品时,如何判断锥形瓶中收集到的为环己烯。实验制得的环己烯精品质量低于理论产量,可能的原因是______。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验![]() 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液