题目内容
3.在实验室制取和收集NH3、NO、CH3COOCH2CH3等物质,可供选用的实验装置如图所示(连接用橡胶管未画出):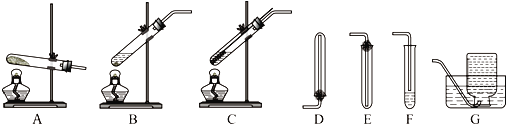
请回答下列问题:
(1)制取和收集氨气应选用的装置是A(填序号),反应的化学方程式是2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,可用碱石灰干燥氨气.
(2)NO的制取最好选用装置C(填序号,下同),用G装置收集NO气体.
(3)制取乙酸乙酯的化学方程式是CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,收集装置的试管中盛装饱和Na2CO3溶液,其作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于分层析出,分离乙酸乙酯的方法是分液.
分析 (1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,应用碱石灰干燥氨气;
(2)可用铜和稀硝酸反应制备NO,NO与氧气反应,不溶于水,应用排水法收集;
(3)实验室用乙酸、乙醇在浓硫酸作用下加热制备乙酸乙酯,乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,乙醇易溶于水.
解答 解:(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,可用A装置制备,反应的方程式为2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,应用碱石灰干燥氨气,
故答案为:A;2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;碱石灰;
(2)可用铜和稀硝酸反应制备NO,为控制反应,可用C装置,NO与氧气反应,不溶于水,应用排水法收集,故答案为:C;G;
(3)实验室用乙酸、乙醇在浓硫酸作用下加热制备乙酸乙酯,方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,乙醇易溶于水,分离乙酸乙酯,用分液的方法,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于分层析出;分液.
点评 本题综合考查物质的制备,侧重于学生的实验操作能力的考查,注意把握物质的性质以及实验操作方法,难度不大.

练习册系列答案
相关题目
13.COCl2俗称光气,其中心C原子采用sp2杂化成键.下列对该分子结构的分子中错误的是( )
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |
14.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | |
| C. | 草酸使高锰酸钾溶液褪色:5H2C2O4+2MnO4-+6H+═2Mn2++10 CO2↑+8H2O | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH${\;}_{4}^{+}$+2Ag↓+3NH3+H2O |
11.19世纪中叶,俄国化学家门捷列夫( )
| A. | 提出了原子分子学说 | B. | 提出了元素周期律 | ||
| C. | 制出了第一张元素周期表 | D. | 发现了质量守恒定律 |
18.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.5 mol苯分子中含有C=C双键数目为1.5 NA | |
| B. | 常温常压下,17 g 羟基含有的电子总数为9NA | |
| C. | 标准状况下,11.2 L CHCl3 中含有的共价键数目为2NA | |
| D. | 将1 mol蔗糖与稀H2SO4混合使之完全水解,可生成2NA个葡萄糖分子 |
15.发达国家一些大城市的酸雨以硝酸型为主,原因是这些城区( )
| A. | 硝酸工业发达 | B. | 雷雨天气较多 | C. | 机动车辆较多 | D. | 燃料以煤为主 |
13.由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是( )
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
 ,该化合物中含有的化学键是共价键、离子键.
,该化合物中含有的化学键是共价键、离子键.