��Ŀ����
������Ũ��Ϊ0.1 mol / L������һԪ����Һ��AOH��BOH��COH������AOH�е�c(OH��)��0.01 mol / L��BOH�ĵ����Ϊ1%��COH��c(H+)��1��10��13mol / L�������������ּ����γɵ��Ȼ��ACl��BCl��CCl����Һ�����ʵ���Ũ����ͬ������£���pH�ɴ�С��˳����
| A��ACl��BCl��CCl | B��CCl��ACl��BCl |
| C��CCl��BCl��ACl | D��BCl��ACl��CCl |
B
AOH�е�c(OH��)��0.01 mol / L����AOH�ĵ������10����COH��c(H+)��1��10��13mol / L�������ˮ�����ӻ�������֪��c(OH��)��0.1 mol / L������COH��ǿ�������ǿ��˳����COH��AOH��BOH����Խ������Ӧ����Խ����ˮ�⣬��Һ����Խǿ������ѡ��B��ȷ��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 2B(g)+C(g)������ӦΪ���ȷ�Ӧ����ҪʹB�����ʵ�����������Ӧ���ʽ��ͣ��ɲ�ȡ�Ĵ�ʩ��
2B(g)+C(g)������ӦΪ���ȷ�Ӧ����ҪʹB�����ʵ�����������Ӧ���ʽ��ͣ��ɲ�ȡ�Ĵ�ʩ�� CH3OH(g)����ģ�Ⲣ�����÷�Ӧ��
CH3OH(g)����ģ�Ⲣ�����÷�Ӧ��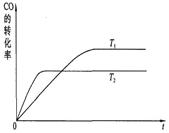
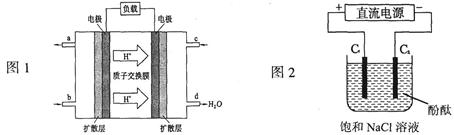
 2SO3�����2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________��
2SO3�����2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________��



 N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬

 2CO(g)��K1
2CO(g)��K1 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�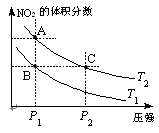
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)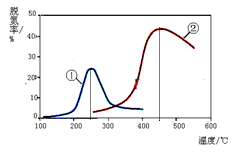
 ����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ�
����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ�