题目内容
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

以上反应中,原子利用率最高的是 。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

以上反应中,原子利用率最高的是 。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。
(1)保护臭氧层(1分) (2) C (1分)
(3)CO2(g) +3 H2(g)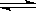 CH3OH(l) +H2O(g) △H=-49kJ·mol-1(2分)
CH3OH(l) +H2O(g) △H=-49kJ·mol-1(2分)
(4)0.225mol·L-1·min-1(2分) 5.3 或 16/3(2分。对单位不做要求,若写了单位但单位错误扣除1分)
(5)2.8×10-5 mol/L(2分,无单位或单位书写错误扣除1分)
(3)CO2(g) +3 H2(g)
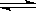 CH3OH(l) +H2O(g) △H=-49kJ·mol-1(2分)
CH3OH(l) +H2O(g) △H=-49kJ·mol-1(2分)(4)0.225mol·L-1·min-1(2分) 5.3 或 16/3(2分。对单位不做要求,若写了单位但单位错误扣除1分)
(5)2.8×10-5 mol/L(2分,无单位或单位书写错误扣除1分)
(1)氟利昂能平衡臭氧层,所以有利于保护臭氧。
(2)反应c反应物中的原子全部转化到目标物质中,原子利用率最高。
(3)4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,则44gCO2放出的热量就是49kJ,所以热化学方程式为CO2(g) +3 H2(g)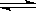 CH3OH(l) H2O(g)△H=-49kJ·mol-1。
CH3OH(l) H2O(g)△H=-49kJ·mol-1。
(4)根据图像可知起始时CO2的浓度是1.00mol/L的,说明容器容积是1L。10min时反应达到平衡状态,平衡时CO2的浓度是0.25mol/L,因此消耗CO2的浓度是0.75mol./L。根据方程式可知消耗氢气的浓度是0.75mol./L×3=2.25mol/L,所以氢气的反应速率为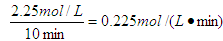 。平衡时
。平衡时
氢气的浓度是3.0mol/L-2.25mol/L=0.75mol/L,所以平衡常数为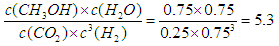
(5)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需
CaCl2溶液的最小浓度为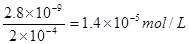 ,所以混合之前的浓度为2.8×10-5 mol/L。
,所以混合之前的浓度为2.8×10-5 mol/L。
(2)反应c反应物中的原子全部转化到目标物质中,原子利用率最高。
(3)4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,则44gCO2放出的热量就是49kJ,所以热化学方程式为CO2(g) +3 H2(g)
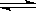 CH3OH(l) H2O(g)△H=-49kJ·mol-1。
CH3OH(l) H2O(g)△H=-49kJ·mol-1。(4)根据图像可知起始时CO2的浓度是1.00mol/L的,说明容器容积是1L。10min时反应达到平衡状态,平衡时CO2的浓度是0.25mol/L,因此消耗CO2的浓度是0.75mol./L。根据方程式可知消耗氢气的浓度是0.75mol./L×3=2.25mol/L,所以氢气的反应速率为
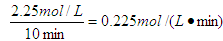 。平衡时
。平衡时氢气的浓度是3.0mol/L-2.25mol/L=0.75mol/L,所以平衡常数为
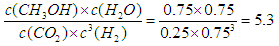
(5)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需
CaCl2溶液的最小浓度为
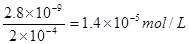 ,所以混合之前的浓度为2.8×10-5 mol/L。
,所以混合之前的浓度为2.8×10-5 mol/L。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO(g)+H2O(g)
CO(g)+H2O(g)

 CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1 
 xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是 2C(g)
2C(g) 
 xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充