题目内容
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g) CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:
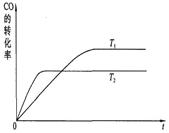
①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。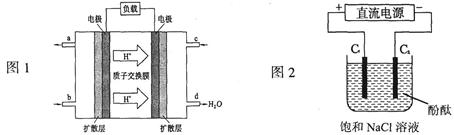
CO(g)+2H2(g)
 CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:

①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。

(1)ac(4分(4分,选一个对得2分,一对一错不得分):
(2)①<(2分) ②>(2分)
(3)①2CH3OH+3O2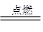 2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
(4)2Cl-+2H2O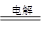 Cl2↑+H2↑+2OH-(3分) C2 (2分)
Cl2↑+H2↑+2OH-(3分) C2 (2分)
(2)①<(2分) ②>(2分)
(3)①2CH3OH+3O2
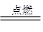 2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)(4)2Cl-+2H2O
 Cl2↑+H2↑+2OH-(3分) C2 (2分)
Cl2↑+H2↑+2OH-(3分) C2 (2分)(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以c正确。根据方程式可知,反应是体积减小的,因此压强也是减小的,所以a也能说明达到平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确。D中反应速率的方向是相同的,不正确。答案选ac。
(2)①根据图像可知,温度为t2的曲线首先达到平衡状态,说明反应速率快,因此t2大于t1。温度高,CO的转化率低,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,即△H<0。
②升高温度,平衡向逆反应方向移动,因此平衡常数减小,即K1>K2。
(3)①甲醇完全燃烧的生成物是水和CO2。所以方程式为2CH3OH+3O2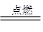 2CO2+4H2O。
2CO2+4H2O。
②氧气在反应中得到电子,因此在正极通入,又因为氢离子向正极移动,所以正极电极反应式为O2+4e-+4H+=2H2O。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气,因此阴极周围水的电离平衡被破坏,溶液显碱性,显红色。由于C2和电源的负极相连,所以
C2是阴极,该电极周围溶液显红色。该反应的方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)①根据图像可知,温度为t2的曲线首先达到平衡状态,说明反应速率快,因此t2大于t1。温度高,CO的转化率低,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,即△H<0。
②升高温度,平衡向逆反应方向移动,因此平衡常数减小,即K1>K2。
(3)①甲醇完全燃烧的生成物是水和CO2。所以方程式为2CH3OH+3O2
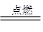 2CO2+4H2O。
2CO2+4H2O。②氧气在反应中得到电子,因此在正极通入,又因为氢离子向正极移动,所以正极电极反应式为O2+4e-+4H+=2H2O。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气,因此阴极周围水的电离平衡被破坏,溶液显碱性,显红色。由于C2和电源的负极相连,所以
C2是阴极,该电极周围溶液显红色。该反应的方程式为2Cl-+2H2O
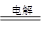 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 2HI(g)达到平衡状态的是 ( )
2HI(g)达到平衡状态的是 ( ) xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( ) 2C(g)
2C(g) 

 C B. 3A+2B
C B. 3A+2B