题目内容
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
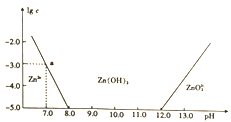
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
【答案】A
【解析】A、根据图中数据,当pH为7.0时,lgc(Zn2+)=-3.0,则溶液中c(Zn2+)=10-3mol/L,c(OH-)=10-7mol/L,所以Zn(OH)2的溶度积(Ksp)=c(Zn2+)c2(OH-)=1.0×10-17,选项A正确;B、溶液中加入足量氨水,发生反应的离子方程式为Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+,选项B错误;C、为提取工业废液中的Zn2+,根据图象,则可以控制pH的范围在8.0~12.0的范围内,选项C错误;D、Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以ZnO22-形式存在,选项D错误。答案选A。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目





