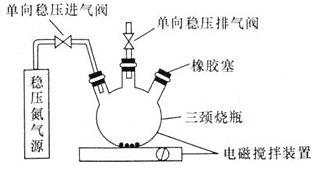
题目内容
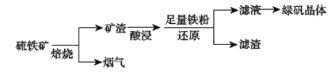
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由________。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
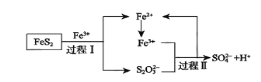
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整______FeS2+______Fe3++_______ ______=7Fe2++______S2O32-+____ ______
②过程II反应的离子方程式________________________________________。
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为______________。(FeSO4·7H2O摩尔质量为278 g/mol)
【答案】Fe2O3 +6H+=2Fe3++3H2O SO2+2NH3H2O=2NH4++SO32-+H2O 取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+ Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解 1 6 3 H2O 1 6 H+ 8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+ ![]()
【解析】
以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO47H2O):焙烧硫铁矿:4FeS2+11O2=2Fe2O3+8SO2、2CuS+3O2=2CuO+2SO2,再酸浸矿渣:Fe2O3 +6H+=2Fe3++3H2O、CuO +2H+=Cu2++H2O,加入足量的铁粉:Fe+Cu2+=Fe2++Cu,过滤,滤渣为Cu、Fe、SiO2,滤液为FeSO4溶液,结晶得到绿矾晶体,
燃料细菌脱硫:过程I;FeS2+6Fe3++3H2O=7Fe2++S2O32-+6H+,将Fe2+氧化为Fe3+,过程II:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+,
根据反应原理,n(绿矾)=6n(K2Cr2O7),据此分析作答。
:(1)矿渣中的Fe2O3与稀H2SO4反应的离子方程式Fe2O3 +6H+=2Fe3++3H2O;
故答案为:Fe2O3 +6H+=2Fe3++3H2O;
(2)烟气中的SO2会污染环境,可用足量氨水吸收,反应为:SO2+2NH3H2O=2NH4++SO32-+H2O;
故答案为:SO2+2NH3H2O=2NH4++SO32-+H2O;
(3)滤液中金属阳离子为Fe2+,用铁氰化钾检验,具体方法为:取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+;
故答案为:取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+;
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量的原因是:Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解;
故答案为:Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解;
(5)①由图可知,过程I为FeS2和Fe3+生成Fe2+和S2O32-,结合电荷守恒、原子守恒可得:FeS2+6Fe3++3H2O=7Fe2++S2O32-+6H+;
故答案为:1;6;3;H2O;1;6;H+;
②过程Ⅱ反应为Fe3+与S2O32-反应生成SO42-和氢离子、Fe2+,反应为:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+;
故答案为:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+;
(6)原理:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则n(FeSO47H2O)=6n(K2Cr2O7)=6ab×10-3mol,
故绿矾晶体纯度为![]()
故答案为:![]()

 世纪百通期末金卷系列答案
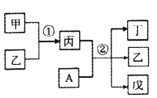
世纪百通期末金卷系列答案【题目】今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:
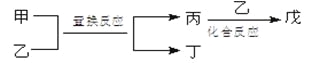
其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | HCOOH |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
A.AB.BC.CD.D