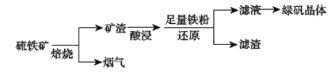
题目内容
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
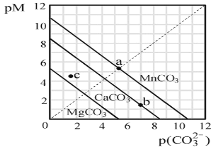
已知pM=-lgc(M),p(CO![]() )=-lgc(CO
)=-lgc(CO![]() )。
)。
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO![]() )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO![]() )
)
D.c点可表示MgCO3的过饱和溶液,且c(Mg2+)<c(CO![]() )
)
【答案】B
【解析】
A.由pM、p(CO32-)的表达式可知,其值越大对应离子的浓度越小,结合沉淀溶解平衡曲线可知,当取相同的c(CO32-)时,对应饱和溶液中,Mg2+、Ca2+、Mn2+的浓度依次减小,则MgCO3、CaCO3、MnCO3的Ksp应该依次减小,A错误;
B.因a点在MnCO3的沉淀溶解平衡曲线上,故a点表示MnCO3的饱和溶液,且a点纵、横坐标相等,故c(Mn2+)=c(CO32-),B正确;
C.b点表示CaCO3的饱和溶液,但是b点:p(CO32-)>p(Ca2+),则c(CO32-)<c(Ca2+),C错误;
D.c点在MgCO3的沉淀溶解平衡曲线上方,为不饱不溶液,且由纵、横坐标关系知:c(Mg2+)<c(CO32-),D错误;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目