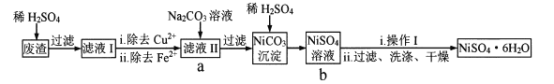
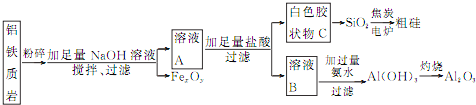
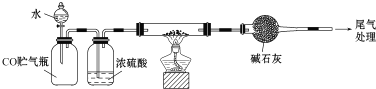
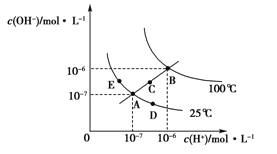
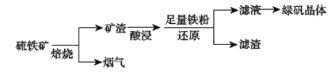
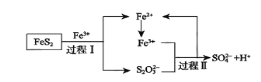
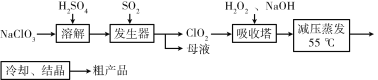
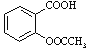
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A __ B___ C ___ D ___
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)____,碱性最强的是______ 。
(3)D所在周期第一电离能最小的元素是_____,电负性最大的元素是_____。(填元素符号)
(4)D的氢化物比C的氢化物的沸点__(填“高”或“低”),原因是 ___________。
(5)E元素原子的核电荷数是____,E元素在周期表的位置是 _____,E元素处于周期表分区中的____区。
(6)画出D的核外电子排布图________,E的外围电子排布图_________。
(7)用电子式表示B的硫化物的形成过程:________________。
【答案】硅 钠 磷 氮 HNO3 NaOH Li F 高 氨气分子间能形成氢键,使氨气的沸点升高 26 第四周期第Ⅷ族 d ![]()
![]()
![]()
【解析】
A、B、C、D是四种短周期元素,A、B、C同周期,A原子M层电子数是L层的一半,即A原子M层4个电子则A为Si元素;B是同周期中第一电离能最小的元素,同周期自左而右第一电离能呈增大趋势(稀有气体除外),则第三周期第一电离能最小的Na,则B为Na元素;C在同周期中未成对电子数最多,故C原子的3p能级有3个电子,故C为P元素; C、D同主族,则D为N;E的外围电子排布式为3d64s2,则为26号元素,故E为Fe元素。
(1) 由分析可知A为硅,B为钠,C为磷,D为氮;
(2) 上述五种元素中氮元素非金属性最强,钠的金属性最强,则最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH;
(3) D所在周期为第二周期,同周期自左而右电负性逐渐增大、第一电离能呈增大趋势(稀有气体除外),故第一电离能最小为Li,电负性最大为F;
(4) D的氢化物为NH3,C的氢化物为PH3,因为氨气分子间能形成氢键,使氨气的沸点升高,所以NH3的沸点高于PH3;
(5) E为Fe元素,原子序数为26,位于周期表第四周期第Ⅷ族, Fe元素处于周期表分区中的d区;
(6) D是N元素,核外电子排布式为1s22s22p3,其核外电子排布图为: ![]() ;E为Fe元素,外围电子排布式为3d64s2,外围电子排布图为:
;E为Fe元素,外围电子排布式为3d64s2,外围电子排布图为:![]() ;
;
(7) B的硫化物为Na2S, Na2S为离子化合物,其用电子式表示的形成过程为![]() 。
。