题目内容
7.用自来水配制的AgNO3溶液,会出现浑浊.过滤出沉淀,向其中加入稀HNO3沉淀不溶解,请你分析该沉淀的成份是AgCl,说明自来水中含有Cl-离子(用化学式符号填写),该反应的离子方程式为Ag++Cl-═AgCl↓.分析 和硝酸银应反应生成白色不溶于硝酸的白色沉淀只有氯化银.
解答 解:用自来水配制的AgNO3溶液,会出现白色不溶于硝酸的沉淀,则一定是氯化银,证明自来水中含有氯离子,离子方程式为Ag++Cl-═AgCl↓,故答案为:AgCl;Cl-;Ag++Cl-═AgCl↓.
点评 本题考查氯离子的检验方法,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
15.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 | |
| B. | 汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 | |
| C. | 1kg人体脂肪可存储约32 200kJ能量.一般人每行走1km 大约要消耗170kJ 能量,如果每天步行5km,一年(按365天计)中消耗的脂肪大约是9.6kg | |
| D. | 炒菜用铁锅未及时洗净(残液中含NaCl),可能发生电化学腐蚀生成红褐色锈斑 |
2.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1
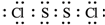 .
.