题目内容
【题目】海水是一个巨大的化学资源宝库.利用海水可以获得许许多多化工产品。
(1)由海水经过晾硒可制得粗盐.实验室去除掉粗盐中的泥沙所需的玻璃仪器有_________________。
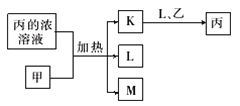
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

①溶液I→Br2的离子方程式为:Br-+BrO3-+H+→Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为____________。
②上图中低浓度尽Br2加Na2CO3,、H2SO4处理的目的是____________。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件巳略去)

巳知生成氢氧化物沉淀的pH如下.
沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
①步骤②中需控制pH=9.8,其目的是____________________________________。
②NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理___________(用化学方程式表示),请你计算,若除去盐卤中含有的0.1 molCO (NH2)2时需消耗NaClO_____g。
【答案】 漏斗、玻璃棒、烧杯 5:1 Br2的富集 使Fe2+、Fe3+、Mn2+完全转化为沉淀而除去 CO (NH2) 2+3NaClO=N2↑+3NaCl+CO2↑+2H2O 22. 35
【解析】(1)实验室去除掉粗盐中的泥沙需要过滤,则所需的玻璃仪器有漏斗、玻璃棒、烧杯;(2)①Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则根据电子得失守恒可知氧化产物溴化钠和还原产物NaBrO3的物质的量之比为5:1;②低浓度Br2加Na2CO3、H2SO4处理后最终得到高浓度的溴,目的是富集Br2;(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g。

 备战中考寒假系列答案
备战中考寒假系列答案