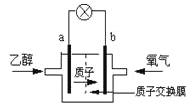
题目内容
【题目】M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N。燃烧9.0 g的N只产生CO2和H2O,且质量分别为13.2 g和5.4 g,实验测得N在标准状况下的蒸气密度为4.02 g/L;N的核磁共振氢谱显示的峰面积之比为 1:1:1: 3
(1)通过计算确定N的分子式。____________
(2)由题知写出N的结构简式,并写出N在催化剂条件下缩聚反应合成M的化学方程式。_________________、__________________________________
【答案】 C3H6O3 ![]()
![]()
【解析】本题主要考查有机物的组成、结构与性质。
(1)13.2gCO2含碳3.6g,5.4gH2O含氢0.6g,所以9.0gN含有3.6g碳、0.6g氢和4.8g氧,N的最简式为CH2O。由N在标准状况下的蒸气密度为4.02 g/L可得N的摩尔质量为90g/mol。由N的最简式和摩尔质量可以得到N的化学式为C3H6O3。
(2)N的核磁共振氢谱显示的峰面积之比为 1:1:1:3,所以N的结构简式为![]() ,N在催化剂条件下缩聚反应合成M的化学方程式为
,N在催化剂条件下缩聚反应合成M的化学方程式为![]() 。
。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】海水是一个巨大的化学资源宝库.利用海水可以获得许许多多化工产品。
(1)由海水经过晾硒可制得粗盐.实验室去除掉粗盐中的泥沙所需的玻璃仪器有_________________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

①溶液I→Br2的离子方程式为:Br-+BrO3-+H+→Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为____________。
②上图中低浓度尽Br2加Na2CO3,、H2SO4处理的目的是____________。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件巳略去)

巳知生成氢氧化物沉淀的pH如下.
沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
①步骤②中需控制pH=9.8,其目的是____________________________________。
②NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理___________(用化学方程式表示),请你计算,若除去盐卤中含有的0.1 molCO (NH2)2时需消耗NaClO_____g。
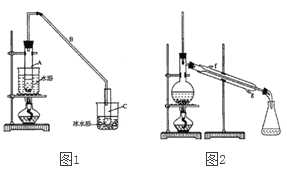
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
己知: 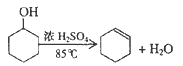
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环乙醇 | 0.96 | 25 | 161 | 能溶于水 |
环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
(1) 制备粗品将12.5 mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________②试管C置于冰水浴中的目的是______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环乙烯在______层(填上或下),分液后用___________(填入编号)洗涤。
a. KMnO4溶液 b.稀 H2SO4 c. Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从________口进入,收集产品时,控制的温度应在______左右。
(3)以下区分环己烯精品和租品的方法,合理的是_____________。
a.用酸性高锰酸钾溶液 b.用NaOH溶液 c.测定沸点