题目内容
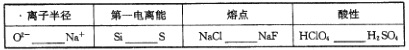
【题目】A、B、C、D、E是中学化学常见单质,X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 反应②的离子方程式为 反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
【答案】⑴ ![]() 四 Ⅷ
四 Ⅷ
⑵ 2Cl-+2 H2O ![]() 2OH-+Cl2↑ + H2↑
2OH-+Cl2↑ + H2↑
2Al+2OH-+2H2O=2AlO![]() + 3H2↑
+ 3H2↑
Al3++3AlO2-+6H2O = 4Al(OH)3↓
(3)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
②ClO-+2I-+2H+=I2+Cl-+H2O , 35.75%
【解析】
试题分析:A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X![]() A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意。综上所述转化关系中的物质分别是:A、H2;B、Na;C、Cl2;D、Al;E、Fe;H、FeCl2;K、AlCl3;M、Al(OH)3;N、FeCl3;W、HCl;X、NaCl;Y、NaOH;Z、NaAlO2;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意。综上所述转化关系中的物质分别是:A、H2;B、Na;C、Cl2;D、Al;E、Fe;H、FeCl2;K、AlCl3;M、Al(OH)3;N、FeCl3;W、HCl;X、NaCl;Y、NaOH;Z、NaAlO2;
(1)Y为NaOH,NaOH是离子化合物,电子式为![]() ;构成E单质的元素是铁,铁元素在周期表中位于第四周期第Ⅷ族。
;构成E单质的元素是铁,铁元素在周期表中位于第四周期第Ⅷ族。
(2)反应①是电解食盐水生成NaOH、氯气和氢气,离子方程式为2Cl-+2 H2O ![]() 2OH-+Cl2↑+ H2↑;
2OH-+Cl2↑+ H2↑;
反应②是铝与NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO![]() +3H2↑;
+3H2↑;
反应③是NaAl02+AlCl3→Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O = 4Al(OH)3↓。
(3)①工业上用氯气和石灰乳反应来制取漂白粉,则化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②漂白粉的有效成分是Ca(ClO)2,ClO-具有氧化性,能将I-氧化成I2,根据得失电子守恒、电荷守恒和原子守恒配平,发生反应的离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O;根据化学反应ClO-+2I-+2H+=I2+Cl-+H2O、2Na2S2O3+I2=Na2S4O6+2NaI,得关系式为ClO-—2Na2S2O3,根据题给数据,Na2S2O3的物质的量为0.1mol/L×0.02L=0.002mol,所以ClO-总的物质的量为0.01mol,该漂白粉中有效成分的质量分数为(0.005mol×143g/mol)÷2g×100%=35.75%。

【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是( )
Y | Z | ||
X | W |
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W