��Ŀ����
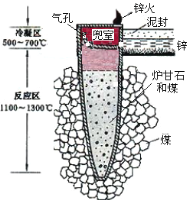
����Ŀ��ij��ѧ�С�������ͼ��ʾ(���ּг�װ������ȥ)ʵ��װ�ã���̽����ʪ��Cl2��Na2CO3��Ӧ�õ��Ĺ������ʡ�

��д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��д���Լ�Y�����ƣ�__________________��
����֪��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ����ɫ�����壬��Ϊ�������������ȷ������C�к��Ȼ�����(��)ֻ��һ�֣��Һ���NaHCO3���ֶ�C�ijɷֽ��в����̽����
����������衣
����1���������ֳɷ֣�NaHCO3��_____________��
����2���������ֳɷ֣�NaHCO3��_____________��_____________��
����Ʒ���������ʵ�顣��д��ʵ�鲽���Լ�Ԥ������ͽ���(�ɲ�����)��
��ѡʵ���Լ�������������ˮ��ϡHNO3��BaCl2��Һ������ʯ��ˮ��AgNO3��Һ���Թܡ�С�ձ���
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡC�е�����������Ʒ���Թ��У��μ���������ˮ�������ܽ⣬Ȼ��������Һ�ֱ�����a��b�Թ��� | �� |
����2�� | |
����3�� |
����֪C����0.1 mol Cl2�μӷ�Ӧ��������1����������֪C�з�Ӧ�Ļ�ѧ����ʽΪ___________________��
���𰸡�(1)4HCl(Ũ)��MnO2MnCl2��Cl2����2H2O��
(2)����ʳ��ˮ(���Ȼ�����Һ) ��
(3)NaCl��Na2CO3��NaCl��
ʵ�鲽�� | Ԥ������ͽ��� |
����2����a�Թ��еμ�BaCl2��Һ | ��������������֤�������в���̼���ƣ� ������Һ����ǣ�֤�������к�̼���� |
����3����b�Թ��еμӹ�����ϡHNO3��Һ���ٵμ�AgNO3��Һ | ����Һ����ǣ���ϲ���2�����������1��������ϲ���2�����������2���� |
(4)2Cl2��2Na2CO3��H2O===2NaHCO3��2NaCl��Cl2O��
��������
�����������1������ʵ��Ŀ�ģ�̽����ʪCl2��Na2CO3��Ӧ��װ��A��ȡCl2���Լ�XΪŨ���ᣬ��˷�Ӧ����ʽΪ��4HCl(Ũ)��MnO2MnCl2��Cl2����2H2O����2����ȡ����������HCl��HCl���̼���Ʒ�Ӧ���������ţ������ȥ������Լ�Y�DZ���ʳ��ˮ��(3)��Ϊ�����������Cl�Ļ��ϼ����ߣ���ȻCl�Ļ��ϼ۽��ͣ�����1�к���NaHCO3��NaCl��Ҳ�п���Na2CO3δ��ȫ��Ӧ����ʣ�࣬����2ΪNaHCO3��NaCl��Na2CO3������Na2CO3��NaHCO3�����ʣ�����2����a�Թ��еμ�BaCl2��Һ������г������ɣ�˵������Na2CO3�����û�г������ɣ�˵��������Na2CO3������3����NaCl���ڣ����Թ�b�еμ�ϡ���ᣬ�ٵμ�������������г���������ϲ���2�Т٣�˵������1��������ϲ���2�����������2������
ʵ�鲽�� | Ԥ������ͽ��� |
����2����a�Թ��еμ�BaCl2��Һ | ��������������֤�������в���̼���ƣ� ������Һ����ǣ�֤�������к�̼���� |
����3����b�Թ��еμӹ�����ϡHNO3��Һ���ٵμ�AgNO3��Һ | ����Һ����ǣ���ϲ���2�����������1��������ϲ���2�����������2���� |
��4��̼��������Ϊ10.6g������̼Ԫ���غ㣬n(NaHCO3)=10.6/106mol=0.1mol������NaԪ���غ㣬NaCl�����ʵ���Ϊ0.1mol�����ݵ�ʧ������Ŀ�غ㣬�������������Cl�ļ�̬Ϊ��1�ۣ�����Ӧ��Ӧ����ʽΪ��2Cl2��2Na2CO3��H2O===2NaHCO3��2NaCl��Cl2O��