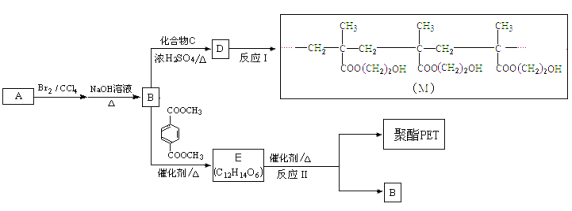
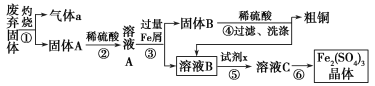
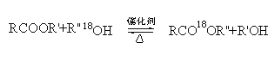题目内容
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
A.平衡时c(NH3)=5mol/L
B.平衡时HI分解率为20%
C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志
D.平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变
【答案】D
【解析】
试题分析:设:碘化铵生成氨气和碘化氢的浓度为x,则
①NH4I(s)![]() NH3(g)+HI(g)
NH3(g)+HI(g)
x x
②2HI(g)![]() H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,即
H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,即
1mol/L 0.5mol/L 0.5mol/L
所以碘化氢的平衡浓度是(x-1)mol/L,根据反应①的平衡常数为20,则x(x-1)=20,解得x=5mol/L;A.由分析可知平衡时c(NH3)=5mol/L,故A正确;B.平衡时HI分解率为![]() ×100%=20%,故B正确;C.反应体系气体的总物质的量始终不变,则混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志,故C正确;D.平衡后缩小容器体积,反应①逆向移动,NH4I的物质的量增加,HI的物质的量降低,反应②逆向移动,则I2的物质的量也减小,故D错误;答案为D。
×100%=20%,故B正确;C.反应体系气体的总物质的量始终不变,则混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志,故C正确;D.平衡后缩小容器体积,反应①逆向移动,NH4I的物质的量增加,HI的物质的量降低,反应②逆向移动,则I2的物质的量也减小,故D错误;答案为D。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目