题目内容
【题目】下列图示与对应的叙述不相符合的是

A.图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) ![]() CH3OH(g)。该反应的 △H=-91 kJ·mol-1
CH3OH(g)。该反应的 △H=-91 kJ·mol-1
B.图乙表示己达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改 变的条件可能处加入催化剂
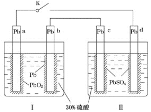
C.图丙中若K1闭合,石墨棒周围液pH逐渐升高;若K2闭合,电路中通过0.002NA 个电子时,两极理论上共产生0.002mol气体
D.图丁表示盐酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲线,该实验的指示剂最好选取酚酞
【答案】D
【解析】
A、根据图甲,反应物的总能量大于生成物的总能量,此反应是放热反应,因此CO(g)+2H2(g)=CH3OH(g) △H=(419-510)kJ·mol-1=-91kJ·mol-1,正确;
B、根据图乙,t0时刻改变某一因素化学反应速率增大,但平衡不一定移动,t0时刻可能加入催化剂,因此催化剂使反应速率加快,但对化学平衡无影响,正确;
C、闭合K1,构成原电池,发生吸氧腐蚀,铁作负极,石墨作正极,即正极反应式为O2+2H2O+4e-=4OH-,c(OH-)增大,pH升高,闭合K2,构成电解池,石墨为阳极,铁为阴极,阳极反应式为2Cl--2e-=Cl2↑,阴极反应式为2H++2e-=H2↑,通过0.02mol电子,两极产生气体的物质的量为(0.01+0.01)mol=0.02mol,正确;
D、NaOH是强碱,0.1mol·L-1NaOH溶液的pH=13,因此曲线的起点错误,盐酸是强酸,因此强酸滴定强碱,指示剂可以是甲基橙,也可以是酚酞,错误。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中② | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。