题目内容
6.某常见二价过渡金属的盐A可发生如图所示的变化,其中B为黑色固体氧化物;C、G为气体氧化物;E为固体单质且不与稀H2SO4反应;D为气体单质;E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G.
请完成下列问题:
(1)A的化学式Cu(NO3)2,D的化学式O2.
(2)B转化为E时,有多种方法,请写出其中一个反应的化学方程式CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
(3)C与H2O反应的化学方程式为3NO2+H2O=2HNO3+NO.
(4)写出E与足量F的浓溶液反应的实验现象:固体溶解、溶液呈蓝色、有红棕色气体生成.
(5)A分解时生成C和D的物质的量之比为4:1.
分析 C、G为气体氧化物,且C与水反应生成 G,则C应为NO2,G为NO,A为常见二价过渡金属的盐,受热分解发生如图所示的变化,其中B为黑色固体氧化物,B还原得E,E为固体单质且不与稀H2SO4反应,则E为Cu,B为CuO,D为气体单质,能与G反应生成C,所以D为O2,结合B、C、D可知,A为Cu(NO3)2,E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G,符合铜与硝酸反应,根据硝酸的浓度不同可以生成NO,也可以生成NO2,符合题中转化关系,据此答题.
解答 解:C、G为气体氧化物,且C与水反应生成 G,则C应为NO2,G为NO,A为常见二价过渡金属的盐,受热分解发生如图所示的变化,其中B为黑色固体氧化物,B还原得E,E为固体单质且不与稀H2SO4反应,则E为Cu,B为CuO,D为气体单质,能与G反应生成C,所以D为O2,结合B、C、D可知,A为Cu(NO3)2,E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G,符合铜与硝酸反应,根据硝酸的浓度不同可以生成NO,也可以生成NO2,符合题中转化关系,
(1)根据上面的分析可知,A为Cu(NO3)2,D为O2,
故答案为:Cu(NO3)2;O2;
(2)氢气还原氧化铜可得铜,反应的化学方程式为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,
故答案为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(3)C为NO2,C与H2O反应的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(4)铜与足量浓硝酸反应的实验现象为固体溶解、溶液呈蓝色、有红棕色气体生成,
故答案为:固体溶解、溶液呈蓝色、有红棕色气体生成;
(5)Cu(NO3)2分解生成NO2和O2时,NO2是还原产物,生成1molNO2,转化1mol电子,O2是氧化产物,生成1molO2,转化4mol电子,根据氧化还原反应中得失电离守恒可知,生成NO2和O2的物质的量之比为4:1,
故答案为:4:1.
点评 本题考查无机物的推断,题目难度中等,本题侧重于常见元素化合物知识的考查,注重于氮元素及其化合物的考查,学习中注意牢固把握相关基础知识.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁烯 |
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
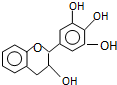 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 一定条件下的氧化产物能发生银镜反应 |
| A. | 当A、B都是金属,A的还原性一定比B强 | |
| B. | 当A、B都是非金属时,A的非金属性一定比B强 | |
| C. | 当A是金属时,B可能是金属,也可能是非金属 | |
| D. | 当A是非金属时,B可能是非金属,也可能是金属 |
| A. | ds区 | B. | d区 | C. | f区 | D. | s区和p区 |
 HCl
HCl