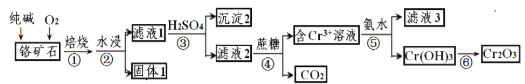
题目内容
【题目】金属铜的冶炼方法较早的为人类掌握,人们用铜合金制造各种青铜器,古代的青铜器表面会有铜锈(碱式碳酸铜)生成,其成分可表示为:xCuCO3·yCu(OH)2·zH2O,实验室测定碱式碳酸铜成分的方法有多种。
(1)氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式_________________;
②实验装置用下列仪器连接而成:
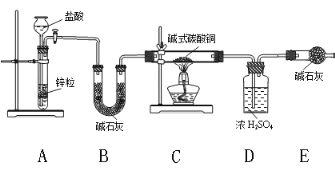
ⅰ、B装置的作用_________,装置中的一个明显缺陷,改进方法是_________________。
ⅱ、称取24 g某碱式碳酸铜样品进行试验,经数据分析处理,反应得到12.8g残留物,4.4g二氧化碳和7.2 g水。该样品中的结晶水质量为__________g,化学式为______________;
(2)某同学认为氢气还原法装置太复杂,提出简化的方法,认为可以只用C、D、E和改进后的装置直接加热碱式碳酸铜分解,你认为是否可行?请说明理由____________________。
【答案】xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O除去氢气中的杂质HCl(g)和H2O(g)E后面加一个碱石灰的干燥管1.8CuCO3·Cu(OH) 2·H2O不可行,分解生成的气体不能完全被D、E装置吸收
(x+y)Cu+xCO2↑+(x+2y+z)H2O除去氢气中的杂质HCl(g)和H2O(g)E后面加一个碱石灰的干燥管1.8CuCO3·Cu(OH) 2·H2O不可行,分解生成的气体不能完全被D、E装置吸收
【解析】
(1)H2还原碱式碳酸铜生成Cu、CO2和H2O。装置A中Zn与反应盐酸制取H2;H2中混有HCl(g)和H2O(g),装置B中的碱石灰用于除去H2中的HCl(g)和H2O(g);装置C中H2还原碱式碳酸铜;装置D中浓硫酸吸收反应生成的H2O;装置E中碱石灰吸收反应生成的CO2;该装置的缺陷是:外界空气可以进入E中,使测得的CO2的质量偏高。由CO2的质量和C守恒计算n(CuCO3),由残留物的质量和Cu守恒计算n[Cu(OH)2],结合晶体的质量计算结晶水的质量和物质的量,计算化学式。
(2)直接加热碱式碳酸铜使其分解的方法不可行,分解生成的H2O(g)、CO2不能完全被D、E装置吸收。
(1)①H2还原碱式碳酸铜生成Cu、CO2和H2O,xCuCO3·yCu(OH)2·zH2O与H2反应的化学方程式为(x+y)H2+xCuCO3·yCu(OH)2·zH2O![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O。答案为:(x+y)H2+xCuCO3·yCu(OH)2·zH2O
(x+y)Cu+xCO2↑+(x+2y+z)H2O。答案为:(x+y)H2+xCuCO3·yCu(OH)2·zH2O![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O
(x+y)Cu+xCO2↑+(x+2y+z)H2O
②i.装置A中Zn与反应盐酸制取H2;H2中混有HCl(g)和H2O(g),装置B中的碱石灰用于除去H2中的HCl(g)和H2O(g)。装置C中H2还原碱式碳酸铜;装置D中浓硫酸吸收反应生成的H2O;装置E中碱石灰吸收反应生成的CO2;该装置的缺陷是:外界空气可以进入E中,E中碱石灰吸收空气中CO2和H2O(g),使测得的CO2的质量偏高,改进方法是:E后面加一个盛碱石灰的干燥管。答案为:除去H2中的HCl(g)和H2O(g) E后面加一个盛碱石灰的干燥管
ii.n(Cu)=![]() =0.2mol,反应生成的n(CO2)=
=0.2mol,反应生成的n(CO2)=![]() =0.1mol,根据C守恒,原样品中n(CuCO3)=n(CO2)=0.1mol,根据Cu守恒,原样品中n[Cu(OH)2]=0.2mol-0.1mol=0.1mol,该样品中结晶水的质量为24g-0.1mol×124g/mol-0.1mol×98g/mol=1.8g。结晶水物质的量为
=0.1mol,根据C守恒,原样品中n(CuCO3)=n(CO2)=0.1mol,根据Cu守恒,原样品中n[Cu(OH)2]=0.2mol-0.1mol=0.1mol,该样品中结晶水的质量为24g-0.1mol×124g/mol-0.1mol×98g/mol=1.8g。结晶水物质的量为![]() =0.1mol,x:y:z=0.1mol:0.1mol:0.1mol=1:1:1,化学式为CuCO3·Cu(OH)2·H2O。答案为:1.8 CuCO3·Cu(OH)2·H2O
=0.1mol,x:y:z=0.1mol:0.1mol:0.1mol=1:1:1,化学式为CuCO3·Cu(OH)2·H2O。答案为:1.8 CuCO3·Cu(OH)2·H2O
(2)直接加热碱式碳酸铜使其分解的方法不可行,因为分解生成的H2O(g)、CO2有部分残留在装置中,不能完全被D、E装置吸收。答案为:不可行,分解生成的H2O(g)、CO2不能完全被D、E装置吸收

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
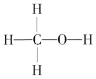
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
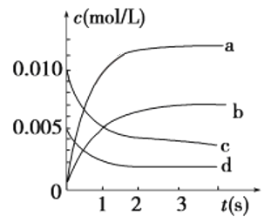
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
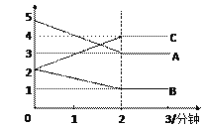
该反应的的化学方程式为________________。