题目内容
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
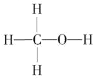
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
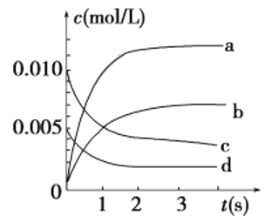
③如下图所示,表示NO2变化曲线的是________。
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
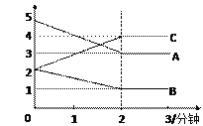
该反应的的化学方程式为________________。
【答案】-175kJ/mol 65% 0.0015 mol/(L.s) b BC 2A+B![]() 2C
2C
【解析】
(1)①拆开3mol H2 (g)和1mol CO2(g)中化学键所吸收的总能量为3×436kJ+2×745 kJ=2798 kJ,形成1mol CH3OH(g) 和1mol H2O(g)所放出的能量是3×412 kJ+351 kJ+3×462kJ=2973 kJ,所以该反应的焓变为2798 kJ/mol -2973 kJ/mol =-175 kJ/mol;
(2) ①到达平衡时NO的转化率为![]() ;
;
②从0~2s内NO平均反应速率为:v(NO)=![]() =0.003molL-1s-1,
=0.003molL-1s-1,
化学反应中反应速率之比等于化学计量数之比,
则v(O2)=![]() v(NO)=
v(NO)=![]() ×0.003molL-1s-1=0.0015molL-1s-1;
×0.003molL-1s-1=0.0015molL-1s-1;
③NO2为生成物,反应中浓度逐渐增大,根据方程式2NO(g)+O2(g)![]() 2NO2(g),可知c(NO2)=c(NO)=2c(O2),
2NO2(g),可知c(NO2)=c(NO)=2c(O2),
则图象中b为NO2的浓度变化曲线,c为NO的浓度变化曲线,d为O2的浓度变化曲线,
故答案为:b;
④A.v(NO2)=2v(O2),没有体现正逆反应速率关系,无法判断是否达到平衡状态,选项A错误;
B.反应2NO(g)+O2(g) ![]() 2NO2(g)为气体体积变化的反应,容器内压强保持不变,说明反应已达平衡状态,选项B正确;
2NO2(g)为气体体积变化的反应,容器内压强保持不变,说明反应已达平衡状态,选项B正确;
C.v逆(NO) =2v逆(O2)=2v正(O2),正逆反应速率相等,说明反应达到平衡状态,选项C正确;
D.反应中气体总质量不变,容器体积不变,故容器内密谋始终保持不变,则容器内的密度保持不变不能说明反应达平衡状态,选项D错误。
答案选BC;
(3)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C。

【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D