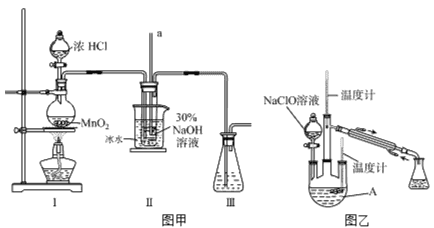
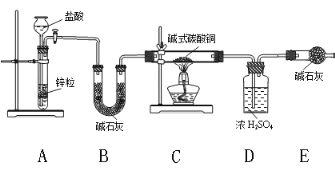
题目内容
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
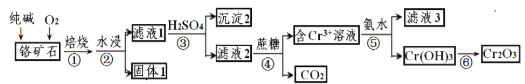
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为_________________;
(2)沉淀2的化学式为__________;
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式____________________,硫酸能否换成盐酸并说明其理由___________________;
(4)滤液3中的主要溶质是两种盐,其化学式为__________________________;
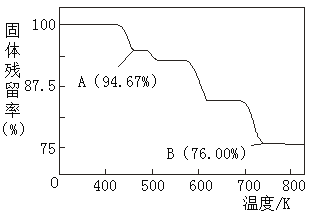
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________。
【答案】Cr(OH)3+OH-=2H2O+CrO2-H2SiO32CrO42-+2H+![]() Cr2O72-+H2O不能,HCl可能被CrO42-氧化成氯气Na2SO4 (NH4)2SO4Cr2O3
Cr2O72-+H2O不能,HCl可能被CrO42-氧化成氯气Na2SO4 (NH4)2SO4Cr2O3
【解析】
向铬矿石中加入纯碱和O2焙烧,发生反应2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2、Na2CO3+SiO2
4Na2CrO4+4CO2、Na2CO3+SiO2![]() Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4
Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4![]() Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3,据此分析回答(1)~(4)。根据Cr守恒和B点的固体残留率计算B点物质的化学式。
Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3,据此分析回答(1)~(4)。根据Cr守恒和B点的固体残留率计算B点物质的化学式。
向铬矿石中加入纯碱和O2焙烧,发生反应2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2、Na2CO3+SiO2
4Na2CrO4+4CO2、Na2CO3+SiO2![]() Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4=Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3。
Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4=Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3。
(1)Cr(OH)3和Al(OH)3性质相似,Al(OH)3与KOH反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,则Cr(OH)3与KOH反应的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O。答案为:Cr(OH)3+OH-=CrO2-+2H2O
(2)根据上述分析,沉淀2的化学式为H2SiO3。
(3)步骤③中加入H2SO4将CrO42- 转化成Cr2O72-,反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O。硫酸不能换成盐酸,因为盐酸可被CrO42-氧化成Cl2。答案为:2CrO42-+2H+
Cr2O72-+H2O。硫酸不能换成盐酸,因为盐酸可被CrO42-氧化成Cl2。答案为:2CrO42-+2H+![]() Cr2O72-+H2O 盐酸可被CrO42-氧化成Cl2
Cr2O72-+H2O 盐酸可被CrO42-氧化成Cl2
(4)滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,发生的离子反应为Cr3++3NH3·H2O=Cr(OH)3↓+3NH4+,滤液3中的主要溶质为Na2SO4、(NH4)2SO4。答案为:Na2SO4、(NH4)2SO4
(5)设CrO3物质的量为1mol,1molCrO3的质量为1mol×100g/mol=100g ,n(Cr)=1mol;B点固体残留率为76.00%,B点固体的质量为100g×76.00%=76g,根据Cr守恒,B点物质中n(Cr)=1mol,m(Cr)=1mol×52g/mol=52g,O的质量为76g-52g=24g,n(O)=24g÷16g/mol=1.5mol,n(Cr):n(O)=1mol:1.5mol=2:3,B点时铬的氧化物的化学式为Cr2O3。答案为:Cr2O3

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案