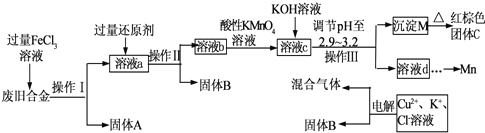
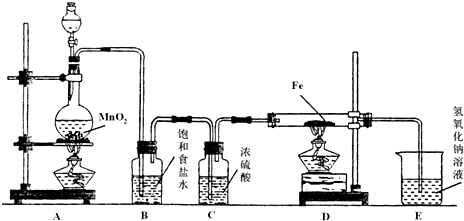
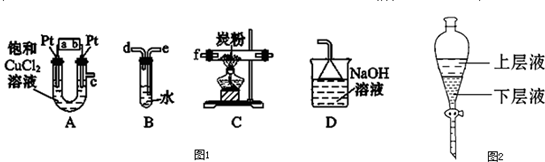
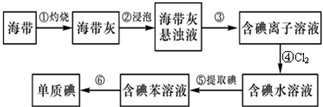
题目内容
某研究性学习小组设计了测定镁原子的摩尔质量的实验(简易装置如下)。 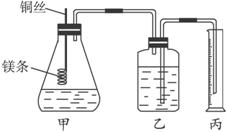
该实验主要操作步骤为:①用砂纸擦去镁条表面的氧化膜,称得质量为a g,系于铜丝末端;②锥形瓶中加有适量的稀硫酸,广口瓶中装有足量的水,连接好装置;③检查装置气密性;④把铜丝向下插入,使镁条完全浸入稀硫酸中至镁条完全溶解;⑤恢复到室温,正确操作读出量筒中水的体积为b mL。
请完成下列问题:
(1)用文字表述步骤③检查该装置气密性的操作与观察方法________________。
(2)本实验除了数据a、b外,还需要测定的其他数据有________________。
(3)如果镁条表面的氧化膜未除去,会导致实验结果________(填“偏大”“偏小”或“不变”)。
(4)若实验是在101 kPa、25 ℃下进行的,水蒸气的影响忽略不计,此时气体摩尔体积约为24.0 L·mol-1,镁原子的摩尔质量的计算式为(可不必简化):M(Mg)=_________。
(1)两手捂住锥形瓶,如果观察到广口瓶中长导管中有一段水柱高于液面,则表明装置不漏气 (2)温度、压强 (3)偏大(4)![]() g·mol-1
g·mol-1
解析:本题的实验反应原理是Mg+H2SO4====MgSO4+H2↑,根据H2的体积(b mL)来反映镁原子的摩尔质量。
(1)两手捂住锥形瓶,如果观察到广口瓶中长导管中有一段水柱高于液面,则表明装置不漏气。
(2)因为要通过H2的体积(b mL)来反映镁原子的摩尔质量,在将H2的体积转化为H2的物质的量时,需考虑测量H2的体积的条件,即温度、压强。
(3)根据反应方程式,得Mg—H2,则M(Mg)=a÷(b×10-3÷Vm)(Vm为实验条件下的气体摩尔体积)。如果未除去镁条表面的氧化膜,样品与酸反应生成H2的体积(b mL)不变,而样品的质量大于a g,所以M(Mg)偏大。
(4)把Vm=24.0 L·mol-1代入M(Mg)=a÷(b×10-3÷Vm)得:
M(Mg)=![]() g·mol-1。
g·mol-1。