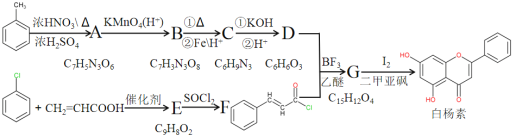
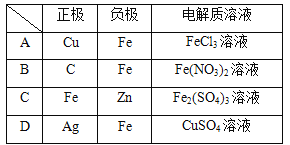
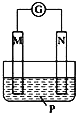
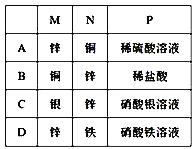
题目内容
【题目】由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论正确的是( )
A.该混合物中一定含有铝B.该混合物中一定含有铁
C.该混合物一定是由铁和镁组成的D.该混合物中一定不含铁
【答案】B
【解析】
标准状况下,2.8L氢气的物质的量=![]() =0.125mol,根据电子转移守恒可知,6g金属合金提供电子的物质的量为0.125mol×2=0.25mol,故提供1mol电子需要混合金属的平均质量为6g×
=0.125mol,根据电子转移守恒可知,6g金属合金提供电子的物质的量为0.125mol×2=0.25mol,故提供1mol电子需要混合金属的平均质量为6g×![]() =24g,镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为
=24g,镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为![]() ×24g/mol=12g,铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为
×24g/mol=12g,铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为![]() ×27g/mol=9g,铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为
×27g/mol=9g,铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为![]() ×56g/mol=28g,Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种;
×56g/mol=28g,Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种;
答案选B。

练习册系列答案
相关题目
【题目】成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项 | 传统文化 | 化学角度解读 |
A | 兰陵美酒郁金香,玉碗盛来琥珀光 | “香”主要因为美酒含有酯类物质 |
B | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe2O3 |
C | 三月打雷麦谷堆 | 在雷电作用下N2转化成能被作物吸收的氮元素 |
D | 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也 | 利用物理方法(焰色反应)可以检验钠盐和钾盐 |
A.AB.BC.CD.D