题目内容
【题目】白杨素对肿瘤细胞有独特的杀伤作用,一种以甲苯、氯苯、丙烯酸为原料合成白杨素的路线如下:
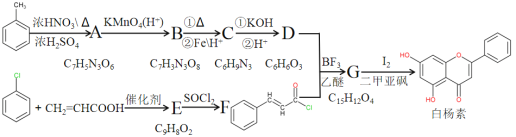
回答下列问题:
(1) A的名称是:__________________。
(2) C和D中不同化学环境的氢原子都为两种,则C和D的结构简式分别为:______、______。
(3) “D+F→G”的方程式为:_____________,物质E经“E→F”过程后再与D反应可大大减少副产物__________的生成。
(4) “G→白杨素”的反应类型为:_____________。试剂I2的选择是整个合成路线的关键。I2不能用更易结合H原子的Cl2替代的原因是:___________________。
(5) 下列关于白杨素的说法正确的是:_________。
A.白杨素的分子式C15H9O4
B.白杨素遇FeCl3溶液发生显色反应
C.与溴水反应,1mo白杨素最多消耗3molBr2
D.与足量H2发生加成反应后,白杨素分子中官能团种类减少1种
(6) E有多种同分异构体,满足分子中含有苯环,且能与4倍物质的量的银氨溶液反应的种类数有_________种,其中不同化学环境的氢原子有4种的结构简式为:______。
【答案】三硝基甲苯 ![]()
![]()
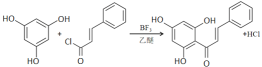
 取代反应 防止有强氧化性的Cl2氧化羟基 BC 10
取代反应 防止有强氧化性的Cl2氧化羟基 BC 10  、
、
【解析】
根据流程图可知,甲苯在浓硫酸浓硝酸的作用下,生成三硝基甲苯(再结合A的分子式为C7H5N3O6),三硝基甲苯与酸性高锰酸钾溶液中反应得到三硝基苯甲酸(恰好B的分子式为C7H3N3O8),再结合C的分子式为C6H9N3可知C的结构简式为![]() ,再根据D的分子式为C6H6O3,故D的结构简式为:
,再根据D的分子式为C6H6O3,故D的结构简式为:![]() ,G的分子式为C15H12O4,可知G的结构简式为:
,G的分子式为C15H12O4,可知G的结构简式为:![]() ,结合F的结构简式和E的分子式可知E的结构简式为:
,结合F的结构简式和E的分子式可知E的结构简式为: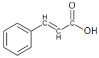 ,这样整个流程图就推导顺畅了,再进行下面的解题就不是很困难了。
,这样整个流程图就推导顺畅了,再进行下面的解题就不是很困难了。
(1)根据流程图可知,甲苯在浓硫酸浓硝酸的作用下,生成三硝基甲苯(A的分子式为C7H5N3O6),故A的名称是三硝基甲苯,故答案为:三硝基甲苯;
(2) 结合C和D的分子式,以及C和D中不同化学环境的氢原子都为两种,可以确定C和D的结构简式分别为:![]() 、
、![]() ,故答案为:
,故答案为:![]()
![]() ;
;
(3)根据分析得出,D、F、G的结构简式,故“D+F→G”的方程式为: ,根据E和D的结构简式可知,二者进行酯化反应,所得物质为:
,根据E和D的结构简式可知,二者进行酯化反应,所得物质为: ,故物质E经“E→F”过程后再与D反应可大大减少副产物
,故物质E经“E→F”过程后再与D反应可大大减少副产物 的生成,故答案为:
的生成,故答案为:
 ;
;
(4) 比较G和白杨素的结构简式可以得出,“G→白杨素”的过程相当于分子内的取代反应,故反应类型为取代反应,由于Cl2具有强氧化性,G中含有酚羟基具有强还原性,故若用Cl
(5) A.白杨素的分子式C15H10O4,故A错误;
B.白杨素含有酚羟基,故遇FeCl3溶液发生显色反应,故B正确;
C.与溴水反应,主要发生在酚羟基的邻、对位上,和碳碳双键,故1mo白杨素最多消耗3molBr2,故C正确;
D.白杨素分子中含有酚羟基、羰基、醚键和碳碳双键四种官能团,而与足量H2发生加成反应后分子中的官能团为羟基、醚键2种,白杨素分子中官能团种类减少2种,故D错误;
故答案为:BC;
(6) E的结构简式为 ,能与4倍物质的量的银氨溶液反应说明该同分异构体中含有两个醛基,故同分异构体含有两个醛基、一个甲基,或者一个次甲基连两个醛基有:
,能与4倍物质的量的银氨溶液反应说明该同分异构体中含有两个醛基,故同分异构体含有两个醛基、一个甲基,或者一个次甲基连两个醛基有:![]() (2种)
(2种)![]() (3种)
(3种)![]() (1种)
(1种)![]() (3种)和
(3种)和![]() 共10种,其中不同化学环境的氢原子有4种的结构简式为:
共10种,其中不同化学环境的氢原子有4种的结构简式为: 、
、 ,故答案为:10 ;
,故答案为:10 ; 、
、 。
。

【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060


