题目内容
已知2H2(g)+O2(g)→2H2O(g) ΔH= -484KJ/mol;2H2(g)+O2(g)→2H2O(l) ΔH= -572KJ/mol
若在标准状况下,将H2和O2组成的混合气体点燃爆炸后,再恢复到标准状况下,气体总体积减少33.6升,计算反应过程中放出的热量是多少?(要求简要解析)
若在标准状况下,将H2和O2组成的混合气体点燃爆炸后,再恢复到标准状况下,气体总体积减少33.6升,计算反应过程中放出的热量是多少?(要求简要解析)
286KJ
根据方程式可知2H2(g)+O2(g)=2H2O(l),每生成2mol水,气体体积就减少3mol。实际减少的是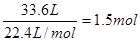 ,所以应该生成水的物质的量是1mol。所以放出的热量是
,所以应该生成水的物质的量是1mol。所以放出的热量是 。
。
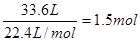 ,所以应该生成水的物质的量是1mol。所以放出的热量是
,所以应该生成水的物质的量是1mol。所以放出的热量是 。
。
练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1

 则1 mol C与
则1 mol C与 反应生成CO的反应热
反应生成CO的反应热 H为
H为
 +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol