题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将 NaOH溶液与 NH4Cl 溶液混合生成 NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________。
II.根据下图所示装置图回答以下问题。
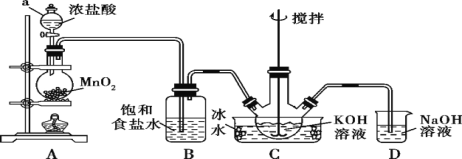
(1)实验室中现有药品Na2S、KMnO4、浓盐酸,某同学验证氯的非金属性大于硫,请写出试管中发的离子反应方程式______
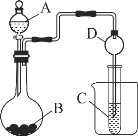
(2)甲同学根据元素非金属性与对应最高价含氧酸之间关系,设计了如图装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;写出选用物质的名称:A__,B__,C___;上述反应的离子方程式_____;_____。
【答案】不合理,NH3·H2O并非为N的最高价氧化物对应的水化物 S2-+Cl2=S+2Cl- 稀硝酸 碳酸钙或其它碳酸盐 硅酸钠溶液 CaCO3+2H+=Ca2++2CO2↑+H2O SiO32-+CO2+H2O═H2SiO3↓+CO32-
【解析】
Ⅰ.元素的最高价氧化物的水化物的碱性越强,元素的金属性越强;
Ⅱ.(1)KMnO4与浓盐酸反应生成氯气,氯气置换出Na2S中的硫;
(2)要证明非金属性:N>C>Si,硝酸与碳酸钙反应生成二氧化碳、二氧化碳和硅酸钠反应生成难溶性的硅酸来证明。
Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而NH3H2O不是氮元素的最高价氧化物的水化物。
(1)试管中氯气与Na2S反应生成氯化钠和硫,反应的离子反应方程式是S2-+Cl2=S+2Cl-;
(2)硝酸与碳酸钙反应生成二氧化碳、二氧化碳和硅酸钠反应生成难溶性的硅酸,可以证明非金属性:N>C>Si;则选用物质的名称:A是稀硝酸,B是碳酸钙,C是硅酸钠溶液;稀硝酸与碳酸钙反应的离子方程式是CaCO3+2H+=Ca2++2CO2↑+H2O;二氧化碳与硅酸钠溶液反应的离子方程式是SiO32-+CO2+H2O═H2SiO3↓+CO32-。