题目内容
【题目】下列说法正确的是
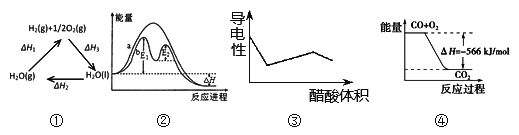
A. 图①中△H1=△H2+△H3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的导电性变化曲线
D. 图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
【答案】C
【解析】A.根据盖斯定律来分析;B.催化剂改变了反应历程, E1、E2分别代表各步反应的活化能;C.醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;D.表示由CO(g)生成CO2(g)的反应能量关系,并不能表示反应过程。
根据盖斯定律可知△H3=-(△H1+△H2)则△H1=-(△H3+△H2),A错误;因为E1>E2图②在催化剂条件下,反应的活化能等于E1,B错误;NaOH 和氨水混合溶液滴入醋酸,NaOH先与醋酸反应生成醋酸钠,氢氧化钠与醋酸钠均为强电解质且离子带电荷数相同,但加入醋酸溶液体积增大,单位体积内电荷数目减少,故溶液导电能力减弱,当氢氧化钠反应完毕滴加醋酸,氨水与醋酸反应生成醋酸铵,醋酸铵为强电解质,一水合氨为弱电解质,故随着醋酸滴入溶液导电能力逐渐增大,当氨水反应完后加入醋酸溶液体积增大,故溶液导电能力逐渐减小,C正确;D项图④只表示由CO(g)生成CO2(g)的反应能量关系,并不能表示反应过程,D错误;正确选项C。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目