题目内容
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
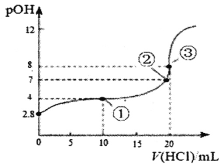
A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
【答案】D
【解析】
A.向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1,盐酸和氨水恰好完全反应生成氯化铵和水,氯化铵中铵根水解显酸性,因而②(pH=7)时,氨水稍过量,即反应未完全进行,从①到②,氨水的量减少,氯化铵的量变多,又溶液导电能力与溶液中离子浓度呈正比,氯化铵为强电解质,完全电离,得到的离子(铵根的水解不影响)多于氨水电离出的离子(氨水为弱碱,少部分NH3·H2O发生电离),因而图中②点所示溶液的导电能力强于①点,A错误;
B.观察图像曲线变化趋势,可推知③为盐酸和氨水恰好完全反应的点,得到氯化铵溶液,盐类的水解促进水的电离,因而溶液pOH=8,则c溶液(OH-)=10-8mol/L,c水(OH-)= c水(H+)=Kw/ c溶液(OH-)=10-6mol/L,B错误;
C.①点盐酸的量是③点的一半,③为恰好完全反应的点,因而易算出①点溶液溶质为等量的NH3·H2O和NH4Cl,可知电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-),又①pOH=4,说明溶液显碱性,则c(OH-)> c(H+),那么c(NH4+)> c(Cl-),C错误;
D.V(HCl)=0时,可知氨水的pOH=2.8,则c(OH-)=10-2.8mol/L,又NH3·H2ONH4++OH-,可知c(NH4+)= c(OH-)=10-2.8mol/L,③点盐酸和氨水恰好反应,因而c(NH3·H2O)=![]() mol/L=0.2mol/L,因而Kb=
mol/L=0.2mol/L,因而Kb=![]() =
=![]() =5×10-5.6mo1·L-1,D正确。
=5×10-5.6mo1·L-1,D正确。
故答案选D。

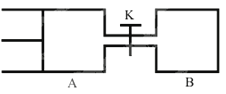
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(3)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。