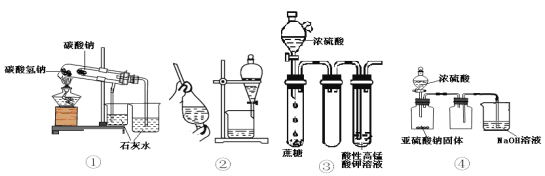
��Ŀ����
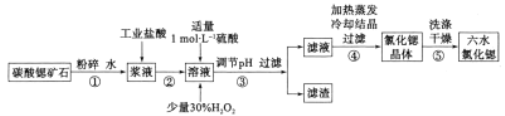
����Ŀ���ߴ���ˮ�Ȼ��Ⱦ���(SrCl2��6H2O)�����л��ϳɵĴ�������̼���ȿ�ʯ(������BaCO3��FeO��SiO2������)�Ʊ��ߴ���ˮ�Ȼ��Ⱦ���Ĺ�����ͼ��ʾ��
��֪��
I��25�棬Ksp[Fe(OH)3]=1��0��10-38 ��Ksp[Fe(OH)2]=1��0��10-16
��SrCl2��6H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
��ش�
(1)������н���ʯ�Ƴɽ�Һ�ܼӿ췴Ӧ���ʵ�ԭ����_____________________________��
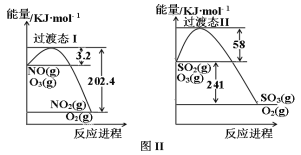
(2)�ڡ���Һ���м��빤ҵ���ᣬ����ȵĽ��������¶ȡ�ʱ��Ĺ�ϵ��ͼ��ʾ��
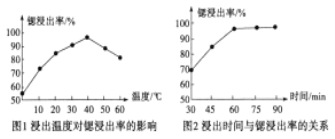
�ݴ˺��ʵĹ�ҵ��������Ϊ_________________________��
(3)����ڡ���Һ���м���30����H2O2����������_____________________________(�����ӷ���ʽ��ʾ)��
(4)�����������������Ҫ�ɷֳ�Fe(OH)3�⣬����_______________________(�ѧʽ)��25�棬ΪʹFe3+������ȫ�������ҺpHֵ��СΪ_____________(������Ũ�ȼ�С��1��0��10-5mol��L-1ʱ������Ϊ������ȫ)��
(5)�������������и������˵������ȷ����___________(����)��
A���������60�����ˮԡ�����������о�Ĥ����
B���������ȴ�ᾧ������Ӧͨ��HC1����
C������ݸ���SrCl2��6H2O������Բ��ü�ѹ����
(6)Ϊ�ⶨ����SrCl2��6H2O(Mr=267)������Ʒ�Ĵ��ȣ���������·�������ȡ1��10g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO31��70g��AgNO3��Һ(��Һ�г�Cl-�⣬����������Ag+��Ӧ���ɳ���������)��C1-����ȫ��������Ȼ���ú�Fe3+����Һ��ָʾ������0��100 mol��L-1��NH4SCN����Һ�ζ�ʣ���AgNO3��Һ��ʹʣ���Ag+��AgSCN��ɫ��������ʽ��������___________ʱ�ﵽ�ζ��յ㣬��ȥNH4SCN��Һ20��00 mL����ԭSrCl2��6H2O����Ĵ���Ϊ________________��(����������1λС��)��
���𰸡�����Ӧ��Ӵ���� 40![]() 2Fe2++H2O2+2H+=2Fe3++2H2O SiO2 ��BaSO4 3 AC ���һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 97.1
2Fe2++H2O2+2H+=2Fe3++2H2O SiO2 ��BaSO4 3 AC ���һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 97.1
��������
��1������Ӱ�컯ѧ��Ӧ���ʵ����أ�����Ӵ�������������¶ȡ�����������Ũ�ȡ����ֽ���ȶ��ܼӿ췴Ӧ���ʽ����жϣ���2������ͼ1��ͼ2�����жϣ���3����̼���ȿ�ʯ(������BaCO3��FeO��SiO2������)�������ˮ�ټӹ�ҵ�����FeO��������ʱ�����������ӣ�˫��ˮ����ǿ�����ԣ����Խ�������������Ϊ�����ӣ����Լ�30����H2O2��ϡ�������������ԭ��Ӧ����Fe2+����ΪFe3+��Ba2+��SO42-����BaSO4������ͨ������pH��ʹ��Һ�е�Fe3+���Fe(OH)3��������ȥ����4�������ܶȻ�������⣻��5�����������Ϣ�������𣻣�6������ʵ����̺�ϵʽ���н��
(1)����Ӱ�컯ѧ��Ӧ���ʵ����أ�����Ӵ�������������¶ȡ�����������Ũ�ȡ����ֽ���ȶ��ܼӿ췴Ӧ���ʡ�������н���ʯ�Ƴɽ�Һ������Ӧ��Ӵ�������ܼӿ췴Ӧ���ʣ��𰸣�����Ӧ��Ӵ������
(2)������Һ���м��빤ҵ���ᣬ�����ȵĽ��������¶ȡ�ʱ��Ĺ�ϵͼ��ͼ1��֪��40��ʱ�ȵĽ�������ߣ���ͼ2��֪60min�ȵĽ�������ߣ����Թ�ҵ�������ʵ�����Ϊ40�棻60min���𰸣�40�棻60min��
(3)���������������������Һ���к���Fe2+������30����H2O2��ϡ���ᣬ�ᷢ��2Fe2++H2O2+2H+=2Fe3++2H2O��H2O2���������������ã��𰸣�2Fe2++H2O2+2H+=2Fe3++2H2O��
(4)�����������������Ҫ�ɷֳ�Fe(OH)3�⣬���в�����ˮ�����SiO2���壬�����й��������ɵ�BaSO4������25�棬Ksp[Fe(OH)3]=1.0��10-38 ��ҪʹFe3+��ȫ������c3(OH-)= Ksp[Fe(OH)3]/ 1.0��10-5=1.0��10-38/1.0��10-5=1.0��10-33�� ����c(OH-)=1.0��10-11mol/L��c(H+)=1.0��10-3����pH=3��ҪʹFe3+������ȫ�������ҺpHֵ��СΪ3���𰸣�SiO2 ��BaSO4��3��
(5) SrCl2��6H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��A���������60�����ˮԡ�����������о�Ĥ���֣��������SrCl2��6H2Oʧȥ�ᾧˮ�����ܼӿ����ʣ���A��ȷ��B����ΪSr�Ľ����Ժ�ǿ��Sr2+����Һ�в��ᷢ��ˮ�⣬���Բ������ȴ�ᾧ�����в���ͨ��HC1���壬��B����C������ݸ���SrCl2��6H2O������ü�ѹ������Լ���SrCl2��6H2O����ʧˮ����C��ȷ���𰸣�AC��
(6) Fe3+Ϊ��ɫ����SCN-����Һ��죻��Fe3+����Һ��ָʾ�������������һ��NH4 SCN��Һʱ����ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��˵���ﵽ�ζ��յ㡣����AgSCN~NH4SCN��֪����AgSCN�����ʵ���n=0.02L��0.100mol/L-1=0.002mol����Cl-��Ӧ��Ag+Ϊ1.70g��170g/mol- 0.002mol=0.008mol������SrCl2��6H2O~2Ag+��֪n(SrCl2��6H2O)=0.004mol��SrCl2��6H2O����Ĵ���=(0.004mol![]() 267g/mol)�� 1.10g��100��=97.1�����𰸣����һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��97.1��
267g/mol)�� 1.10g��100��=97.1�����𰸣����һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��97.1��

 ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�