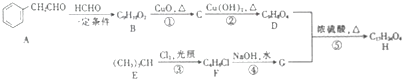
��Ŀ����
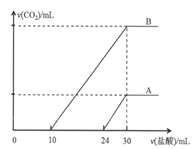
����Ŀ��������30mLͬһŨ�ȵ�NaOH��Һ��ͨ��CO2���壬��CO2ͨ�����IJ�ͬ����Һ�����Ҳ��ͬ���õ���ҺM��N������M��N��Һ����μ���Ũ��Ϊ0.25mol��L��1���ᣬ�������������v(CO2)�������������v(HCl)�Ĺ�ϵ�ֱ�Ϊ��ͼ��ʾ�������A��B��
��ش��������⣺
��1��M��Һ������Ϊ(д��ѧʽ)___________�������ʵ���֮����__________��
��2��N��Һ����Ϊ(д��ѧʽ)____________����״����CO2��������Ϊ________��ԭNaOH��Һ�����ʵ���Ũ��Ϊ_________ ��
���𰸡� NaOH��Na2CO3 3:1 Na2CO3��NaHCO3 112mL 0.25mol/L
�����������ݶ�����̼ͨ������������Һ�п��ܵIJ�����̼���ơ�̼�����ơ�ˮ��M��N����Һ�м���������Һ���Ⱥ����ķ�ӦΪ��HCl+NaOH=NaCl+H2O����Na2CO3+HCl=NaHCO3+NaCl����NaHCO3+HCl=NaCl+CO2+H2O��
��1���������A��M��Һ�з����ķ�Ӧ�����٢ڢ���M�е�����ΪNaOH��Na2CO3�����A��24~30�η����ķ�ӦΪ�ۣ��ٸ��ݷ�Ӧ�ڿ�֪����Һ��̼�������ĵ�������������Ϊ6 mL��˵��̼���Ƶ����ʵ���Ϊ0.006 L![]() 0.25mol��L��1=0.0015mol������������������������Ϊ24-6=18mL�����ݷ�Ӧ�ٿ�֪�������Ƶ����ʵ���Ϊ0.018 L
0.25mol��L��1=0.0015mol������������������������Ϊ24-6=18mL�����ݷ�Ӧ�ٿ�֪�������Ƶ����ʵ���Ϊ0.018 L![]() 0.25mol��L��1=0.0045mol�����������ƺ�̼���Ƶ����ʵ���֮��Ϊ3:1��
0.25mol��L��1=0.0045mol�����������ƺ�̼���Ƶ����ʵ���֮��Ϊ3:1��
��2����ͼ��֪��������������Ϊ30mLʱ�����ٲ������壬ǡ���γ��Ȼ�����Һ���������Ƶ�Ũ�ȵ��������Ũ��Ϊ0.25mol��L��1���ٸ������B��֪��10~30mLΪ̼�����������ᷴӦ������Һ��̼����ת��Ϊ̼�����������ĵ���������ֻ��10mL������������̼�����Ʋ��ܹ��棬˵��N�е�����ΪNa2CO3��NaHCO3��10~30mL�����ķ�Ӧ�ۣ�����CO2��������ʵ���Ϊ0.02 L![]() 0.25mol��L��1=0.005mol���������������Ϊ112 mL��
0.25mol��L��1=0.005mol���������������Ϊ112 mL��

 ��У����ϵ�д�
��У����ϵ�д�