题目内容
2.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |
分析 该原电池中,锌失电子作负极、二氧化锰得电子作正极,负极电极反应为Zn-2e-+2OH-═ZnO+H2O,正极电极反应为2MnO2+2e-+2H2O═2MnO(OH)+2OH-,电子从负极沿导线流向正极.
解答 解:A.该原电池中,锌元素化合价由0价变为+2价,锌失电子作负极,故A错误;
B.该原电池中,锰元素得电子,则MnO2在正极上反应生成MnO(OH),则电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH-,故B正确;
C.该原电池中,锰元素化合价由+4价变为+3价,所以二氧化锰作正极,故C错误;
D.电子从负极沿导线流向之间,不经过电解质溶液,故D错误;
故选B.
点评 本题考查了原电池原理,根据元素化合价变化确定正负极,难点是电极反应式的书写,注意电子不进入电解质溶液,电解质溶液中阴阳离子定向移动形成电流.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
13.下列说法正确的是( )
| A. | 所有的化学反应都有能量变化 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
10.下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
请按要求回答下列问题(用化学用语回答):
(1)写出③的原子结构示意图: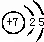 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.
(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程: .
.
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
(1)写出③的原子结构示意图:
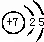 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程:
 .
.(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
17.下列物质中,属于芳香烃且属于苯的同系物的是( )
| A. |  | B. | 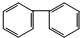 | C. | 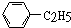 | D. |  |
14.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是最内层电子数的3倍.下列说法不正确的是( )
| A. | 化合物YR4中各原子均满足8电子稳定结构 | |
| B. | 对应原子半径:Z<W<R | |
| C. | W与X、W与Y形成的化合物化学键类型完全相同 | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
11.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q1;
2H2(g)+O2(g)=2H2O(g)△H=-Q2;
H2O(g)=H2O(l)△H=-Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
2H2(g)+O2(g)=2H2O(g)△H=-Q2;
H2O(g)=H2O(l)△H=-Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
12.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D和E形成化合物的类型是共价化合物(填“共价化合物”或“离子化合物”).
(2)B和D简单离子的半径大小为F->Al3+(用离子符号和“>”、“=”或“<”表示).
(3)A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的化学式为:NCl3.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 与E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
(2)B和D简单离子的半径大小为F->Al3+(用离子符号和“>”、“=”或“<”表示).
(3)A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的化学式为:NCl3.
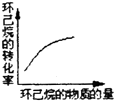
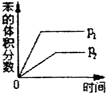
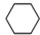 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$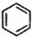 (g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )
(g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )