题目内容
14.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是最内层电子数的3倍.下列说法不正确的是( )| A. | 化合物YR4中各原子均满足8电子稳定结构 | |
| B. | 对应原子半径:Z<W<R | |
| C. | W与X、W与Y形成的化合物化学键类型完全相同 | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
分析 X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价的绝对值相等,处于ⅣA族,Z的核电荷数是Y的2倍,Y只能为C元素,则Z的核电荷数为12,故Z为Mg;由原子序数可知,W、R处于第三周期,W的最外层电子数是最内层电子数的3倍,其最外层电子数为6,故W为S元素,则R为Cl,据此解答.
解答 解:X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价的绝对值相等,处于ⅣA族,Z的核电荷数是Y的2倍,Y只能为C元素,则Z的核电荷数为12,故Z为Mg;由原子序数可知,W、R处于第三周期,W的最外层电子数是最内层电子数的3倍,其最外层电子数为6,故W为S元素,则R为Cl.
A.化合物CCl4中C、Cl原子化合价价电子与其最外层电子数之和均为8,原子均满足8电子稳定结构,故A正确;
B.Mg、S、Cl同周期,随原子序数增大,原子半径减小,故原子半径:Z(Mg)>W(S)>R(Cl),故B错误;
C.W与X形成化合物H2S、W与Y形成的化合物CS2,二者均只含有共价键,故C正确;
D.Y的最高价氧化物对应的水化物为碳酸,属于弱酸,故D正确,
故选B.
点评 本题考查原子结构与元素周期律的关系,推断元素是解题关键,A选项注意8电子结构判断规律,分子中含有H原子一定不满足所有原子均满足8电子结构,难度不大.

练习册系列答案
相关题目
4.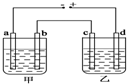 甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
 甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )| A. | 甲槽中溶液是H2SO4,乙槽中溶液是NaOH | |
| B. | 甲槽中溶液是NaOH,乙槽中溶液是AgNO3 | |
| C. | 甲槽中溶液是AgNO3,乙槽中溶液是CuSO4 | |
| D. | 甲槽中溶液是CuSO4,乙槽中溶液是H2SO4 |
5.下列四位同学对“NH4Cl”的认识中,不正确的是( )
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
2.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |
9.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 酸性:H2SiO3>H2CO3>H3PO4 | B. | 稳定性:PH3<H2S<HCl<HF | ||
| C. | 非金属性:Cl>S>P>Si | D. | 离子半径:Cl->F->Na+>Al3+ |
6.下表为元素周期表的一部分,根据表中所列出的元素回答下列问题
(1)最不活泼的元素是Ar(填元素符号),最活泼的非金属元素是F(填元素符号)
(2)可做半导体材料的元素是硅(填元素名称)
(3)氧离子结构示意图为 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③
(4)与水反应最剧烈的金属单质是Na(填元素符号),其反应的化学方程式是2Na+2H2O=2NaOH+H2↑
(5)既能与强酸又能与强碱反应的金属单质是Al(填元素符号)
(6)最高价氧化物的水化物中酸性最强的酸是HClO4写化学式)
(7)气态氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”=;
(8)Al2O3中氧元素质量分数为47.1%.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)可做半导体材料的元素是硅(填元素名称)
(3)氧离子结构示意图为
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③(4)与水反应最剧烈的金属单质是Na(填元素符号),其反应的化学方程式是2Na+2H2O=2NaOH+H2↑
(5)既能与强酸又能与强碱反应的金属单质是Al(填元素符号)
(6)最高价氧化物的水化物中酸性最强的酸是HClO4写化学式)
(7)气态氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”=;
(8)Al2O3中氧元素质量分数为47.1%.
3.下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的是( )
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |
4.某氖原子的质量为a g,一个12C原子质量为b g,NA表示阿伏加德罗常数,则下列说法中正确的是( )
| A. | 氖元素的相对原子质量一定是12a/b | |
| B. | W g该氖原子的物质的量一定是W/(aNA)mol | |
| C. | 该氖原子的摩尔质量是aNA g | |
| D. | W g该氖原子所含的质子数是10 W/(aNA) |