题目内容
12.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 与E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
(2)B和D简单离子的半径大小为F->Al3+(用离子符号和“>”、“=”或“<”表示).
(3)A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的化学式为:NCl3.
分析 短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;
1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;
E的负一价阴离子的电子层结构与Ar原子相同,其质子数为18-1=17,所以E为Cl元素,B与E同主族,则B为F元素,然后结合元素周期律的知识进行解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;E的负一价阴离子的电子层结构与Ar原子相同,其质子数为18-1=17,所以E为Cl元素,B与E同主族,则B为F元素,
(1)D为Al元素、E为Cl元素,二者形成的化合物为氯化铝,氯化铝属于共价化合物,
故答案为:共价化合物;
(2)B为F元素、D为Al元素,氟离子和铝离子都具有相同的核外电子排布,核电荷数越大,离子半径越小,则离子半径大小为:F->Al3+,
故答案为:F->Al3+;
(3)A为N元素,N元素能与F、Na、Al、Cl四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5,该化合物中N元素的化合价为-3,则另一种元素的化合价为-1价,可能为F或Cl元素,结合相对分子质量可知该元素为Cl,该化合物的化学式为:NCl3,
故答案为:NCl3.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据题干信息正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |

| A. | 该温度下,Ksp (BaSO4 )=1.0×10-24 | |
| B. | a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) | |
| C. | d点表示的是该温度下BaSO4的不饱和溶液 | |
| D. | 加入BaCl2可以使溶液由 c点变到a点 |
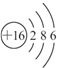
| A. | 氖元素的相对原子质量一定是12a/b | |
| B. | W g该氖原子的物质的量一定是W/(aNA)mol | |
| C. | 该氖原子的摩尔质量是aNA g | |
| D. | W g该氖原子所含的质子数是10 W/(aNA) |

 .
.