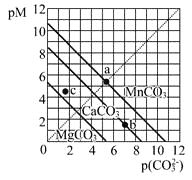
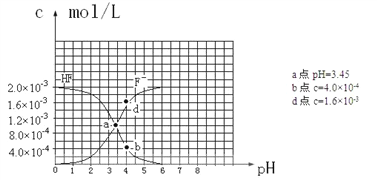
题目内容
【题目】某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液490mL。实验室提供以下仪器:①烧杯 ②100 mL量筒 ③药匙 ④玻璃棒 ⑤托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体的质量为____________;
(2)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 _______________、______________。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_______________;
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?______________。
【答案】 10.0g ①③④⑤ 500mL容量瓶 胶头滴管 BCAFED 搅拌 引流 ② 重新配制溶液
【解析】(1)根据m=nM=cvM计算;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)根据实验操作的步骤;
(4)根据玻璃在实验中的作用;
(5)根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(6)根据实验操作出现的错误应重新配制。
(1)实验室配制0.5molL-1的NaOH溶液490mL,应该配制500 mL,需要NaOH的质量为:0.5L×0.5mol/L×40g/mol=10.0g,故答案为:10.0g;
(2)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器为500mL容量瓶;胶头滴管,故答案为:①③④⑤;500mL容量瓶;胶头滴管;
(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,故答案为:BCAFED;
(4)玻璃在溶解时起到搅拌作用,在移液时起到引流作用,故答案为:搅拌;引流;
(5)①容量瓶实验前用蒸馏水洗干净,但未烘干,无影响,浓度不变,故①错误;
②定容观察液面时俯视,溶液体积偏小,浓度偏大,故②正确;
③配制过程中遗漏了(3)中步骤A,溶质的质量减少,浓度偏低,故③错误;
④加蒸馏水时不慎超过了刻度,溶液体积偏大,浓度偏小,故④错误;
故答案为:②;
(6)实验操作出现加蒸馏水时不慎超过了刻度,则溶液的浓度偏小,应重新配制,故答案为:重新配制。

【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%