题目内容
【题目】下列是元素周期表的一部分:
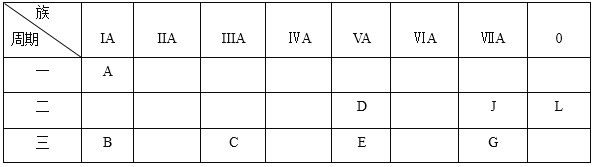
根据以上元素在周期表中的位置,用化学式填写空白。
(1)非金属性最强的元素是_________;化学性质最不活泼的是_________;除L外,原子半径最大的是_________;A与D形成的10电子离子是_________。
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列成序是__________________;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式_________,_________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________。
【答案】 F Ne Na NH4+ (NH2-) NaOH Al(OH)3 H3PO4 HNO3 Na+ ![]() Na+ Na+
Na+ Na+![]() Na+ Cl->F->Na+>Al3+
Na+ Cl->F->Na+>Al3+
【解析】由周期表可知,ABCDEJGL分别为:H、Na、Al、N、P、F、Cl、Ne。
(1)元素周期表中,除0族元素外,右上角元素的非金属性最强,故非金属性最强的元素是F;Ne位于0族,最外层电子数为8,属于惰性气体,化学性质最不活泼;同周期元素随原子序数的增加原子半径逐渐减小,同主族元素随原子序数的增加原子半径逐渐增大,所以原子半径最大的是Na;A与D形成的阳离子是铵根离子化学式为NH4+或阴离子NH2-;
(2)B、C、D、E四种元素的最高价氧化物对应水化物的化学式为:NaOH、Al(OH)3 、HNO3、H3PO4 按碱性逐渐减弱、酸性逐渐增强的顺序为:NaOH、Al(OH)3、H3PO4、HNO3。,
同周期元素随原子序数的增加,其最高价氧化物对应的水化物的碱性逐渐减弱,酸性增强;同主族元素随原子序数的增加,其最高价氧化物对应的水化物的碱性逐渐增强,酸性减弱;
(3)B元素可以形成两种氧化物分别是氧化钠和过氧化钠,两者均为离子化合物,其电子式为Na+![]() Na+、Na+
Na+、Na+ ![]() Na+ ;
Na+ ;
(4)B、C、G、J四种元素分别为Na、Al、Cl、 F,形成的粒子分别为Na+、Al3+、Cl-、F-,粒子半径大小比较的一般规则为电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,所以粒子半径大小排序为Cl->F->Na+>Al3+。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案