题目内容
13.在一密闭容器中,用一不漏气的滑动活塞隔开,常温时在左边充入$\frac{3}{4}$体积H2和O2混合气体,在右边充入$\frac{1}{4}$体积N2,若将左边混合气体点燃充分反应后恢复到原温,活塞停留在中间,则反应前混合气体中H2和O2的体积比可能是( )| A. | 7:2 | B. | 4:5 | C. | 5:4 | D. | 2:7 |
分析 容器中左右两室压强、温度相同,气体摩尔体积相等,气体的物质的量之比等于其体积之比,开始时左右两室气体体积之比为$\frac{3}{4}$:$\frac{1}{4}$=3:1,其物质的量之比为3:1,假设氢气和氧气的物质的量为3mol,氮气的物质的量为1mol;氢气和氧气反应后恢复到原温,活塞停留在中间,其物质的量之比为1:1,氮气的物质的量不变,为1mol,左室剩余气体物质的量为1mol,剩余气体可能是氢气、也可能是氧气,据此分析解答.
解答 解:容器中左右两室压强、温度相同,气体摩尔体积相等,气体的物质的量之比等于其体积之比,开始时左右两室气体体积之比为$\frac{3}{4}$:$\frac{1}{4}$=3:1,其物质的量之比为3:1,假设氢气和氧气的物质的量为3mol,氮气的物质的量为1mol;氢气和氧气反应后恢复到原温,活塞停留在中间,其物质的量之比为1:1,氮气的物质的量不变,为1mol,左室剩余气体物质的量为1mol,剩余气体可能是氢气、也可能是氧气,
假设剩余气体是氢气,根据2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O知,参加反应的氧气物质的量=$\frac{3mol-1mol}{3}$=$\frac{2}{3}$mol,氢气物质的量为$\frac{7}{3}$mol,二者体积之比=$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2;
假设剩余气体是氧气,根据2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O知,参加反应的氢气物质的量=$\frac{3mol-1mol}{3}×2$=$\frac{4}{3}$mol,氧气的物质的量为$\frac{5}{3}$mol,则氢气和氧气体积之比=$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故选AB.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确左右两室体积之比等于其物质的量之比是解本题关键,再利用氢气和氧气反应关系进行计算,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
| A. | 能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I-、NO3- | |
| B. | 将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3的NaHA溶液中粒子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| D. | CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS |
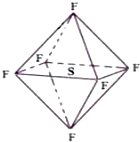 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )| A. | 六氟化硫易燃烧生成二氧化硫 | |
| B. | 六氟化硫中各原子均达到8电子稳定结构 | |
| C. | 六氟化硫分子中的S-F键都是σ键,且键长、键能都相等 | |
| D. | 六氟化硫分子是极性分子 |
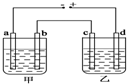 甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )| A. | 甲槽中溶液是H2SO4,乙槽中溶液是NaOH | |
| B. | 甲槽中溶液是NaOH,乙槽中溶液是AgNO3 | |
| C. | 甲槽中溶液是AgNO3,乙槽中溶液是CuSO4 | |
| D. | 甲槽中溶液是CuSO4,乙槽中溶液是H2SO4 |
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.
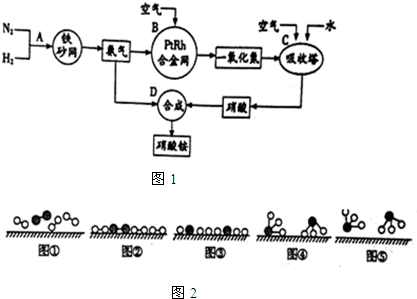
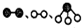 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.