题目内容
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
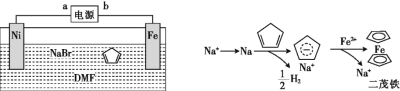
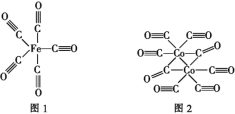
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
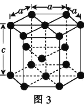
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
【答案】[Ar]3d7或1s22s22p63s23p63d7 10 sp、sp2 O 12 6 ![]()
【解析】
(1)Co为27号元素,Co2+的核外电子数为25,根据构造原理书写核外电子排布式;
(2)1molFe(CO)5中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键;Co2(CO)8中含有碳氧双键和碳氧三键;元素的非金属性越强,电负性越大;
(3)由金属钴的堆积方式为六方最密堆积可知配位数为12;由晶胞结构可知,钴原子有12个位于顶点、2个位于面心、3个位于体内,由均摊法确定原子个数和计算晶体密度。
(1)Co为27号元素,Co2+的核外电子数为25,根据构造原理可知核外电子排布式为:1s22s22p63s23p63d7,故答案为:1s22s22p63s23p63d7;
(2)1molFe(CO)5中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键,共含有10mol配位键;由图可知,Co2(CO)8中含有碳氧双键和碳氧三键,双键中C原子的杂化方式为sp2杂化,三键中C原子的杂化方式为sp杂化;元素的非金属性越强,电负性越大,O元素非金属性最强,则电负性最大的是O元素,故答案为:10; sp、sp2;O;
(3)由金属钴的堆积方式为六方最密堆积可知配位数为12;由晶胞结构可知,钴原子个数为12×![]() +2×
+2×![]() +3=6;由晶胞的边长为a nm,高为c nm可知晶报的体积为
+3=6;由晶胞的边长为a nm,高为c nm可知晶报的体积为![]() ×a×10—7cm×
×a×10—7cm×![]() ×a×10—7cm×c×10—7cm×6=
×a×10—7cm×c×10—7cm×6=![]() ×10—21a2ccm3,则晶胞的密度为
×10—21a2ccm3,则晶胞的密度为![]() =
=![]() g·cm-3,故答案为:12;6;
g·cm-3,故答案为:12;6;![]() 。
。

【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。