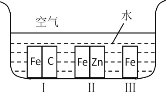
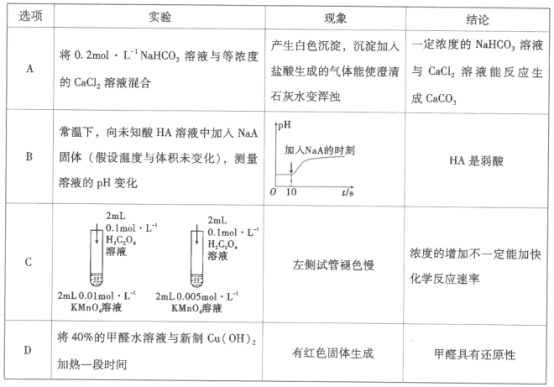
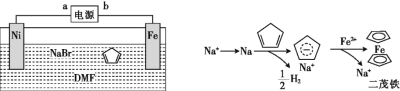
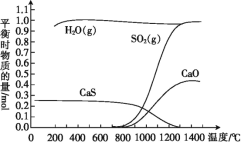
题目内容
【题目】乙醇燃料电池采用硫酸作为电解质溶液,是一种可再生清洁的电池,电池的示意图如图,电池总反应式为C2H5OH+3O2=2CO2+3H2O。
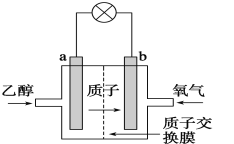
(1)a是___极(选“正”或“负”),发生___反应;电流由___极流向___极(选“a”或“b”),SO42-移向___极(选“a”或“b”)。
(2)随着电池的不断放电,硫酸溶液的物质的量浓度将___。(选“变大”或“不变”或“变小”)
(3)电池的负极电极反应式是___。
【答案】负 氧化 b a a 变小 C2H5OH-12e-+3H2O=2CO2+12H+
【解析】
由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2 +4e-═2H2O,以此解答该。
(1)由质子的移动方向可知a为负极,发生氧化反应;电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,电池中,阴离子向负极移动,所以SO42-向电池的a极迁移;
(2)电池的总反应为C2H5OH+3O2=2CO2+3H2O,随着电池的不断放电,硫酸溶液的物质的量浓度将变小;
(3)由质子的移动方向可知a为负极,乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH-12e-+3H2O=2CO2+12H+。

【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。