题目内容
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
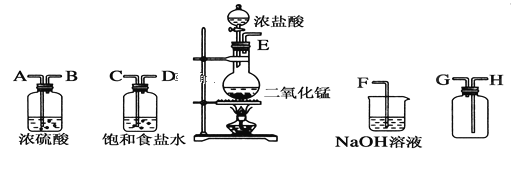
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)①气体发生装置中进行反应的化学方程式:_____________________________;该方程式中体现浓盐酸的__________________、____________________ 性质;氧化剂和还原剂的物质的量之比:________________________________________;
②NaOH溶液中发生反应的离子方程式:_______________________________________;
(4)实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量(_____)
A.①比②多 B.②比①多 C.两种方法一样多 D.无法比较
【答案】E C D A B H G F 除去氯气中的HCl杂质 吸收过量的氯气 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 酸性 还原性 1:2 2OH-+Cl2=Cl-+ClO-+H2O B
MnCl2+2H2O+Cl2↑ 酸性 还原性 1:2 2OH-+Cl2=Cl-+ClO-+H2O B
【解析】
实验目的为制取干燥纯净的氯气,制取氯气时,浓盐酸具有挥发性,则制取的氯气中含有氯化氢、水等杂质,在收集前用饱和食盐水除去HCl杂质,用浓硫酸除去水蒸气,得到干燥的氯气,氯气的密度大于空气,则用长进短出的集气瓶收集氯气,氯气有毒则需进行尾气处理,用NaOH溶液吸收。
(1)根据分析可知,仪器的连接顺序为E、C、D、A、B、H、G、F;
(2)制取氯气的装置中有浓盐酸,具有挥发性,则饱和食盐水的作用为除去氯气中的HCl杂质;氯气有毒,不能直接排放到大气中,则NaOH溶液的作用为吸收过量的氯气;
(3)①实验室用二氧化锰与浓盐酸共热制取二氯化锰、氯气和水,方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;反应中,HCl中的Cl化合价升高,作还原剂,表现还原性;还与二氧化锰反应生成盐和水,表现酸性;二氧化锰作氧化剂,HCl作还原剂,根据方程式,化合价降低的Cl原子为2,则氧化剂和还原剂的物质的量之比为1:2;
MnCl2+2H2O+Cl2↑;反应中,HCl中的Cl化合价升高,作还原剂,表现还原性;还与二氧化锰反应生成盐和水,表现酸性;二氧化锰作氧化剂,HCl作还原剂,根据方程式,化合价降低的Cl原子为2,则氧化剂和还原剂的物质的量之比为1:2;
②NaOH与氯气反应生成氯化钠、次氯酸钠和水,离子方程式为2OH—+Cl2=Cl—+ClO—+H2O;
(4)①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应,随反应的进行,盐酸的浓度减小,到一定程度后则不再反应,生成氯气的物质的量小于2mol;②用87 g 二氧化锰,即1mol与足量浓盐酸反应,若不考虑氯化氢的挥发,可生成2mol氯气,答案为B。