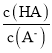题目内容
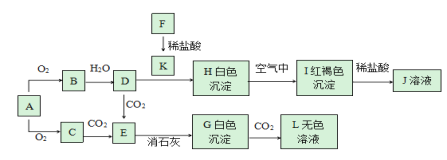
【题目】A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
(1)写出化学式;
A______ ,C______ ,D______ ,E______
(2)写出下列反应的离子方程式:
①A→B: _____________________________________________
②B→E: _____________________________________________
③C→E: _____________________________________________
④F→E: _____________________________________________
【答案】KAlO2 Al2O3 AlCl3 NaAlO2 AlO2-+CO2+2H2O= Al(OH)3↓ + HCO3- Al(OH)3+OH-=AlO2-+2H2O Al2O3+2OH-=2AlO2-+H2O 2Al+2H2O+2OH-=2AlO2-+3H2↑
【解析】
根据图像,B、F均可与酸、碱反应,且电解熔融状态的C,可以生成F,则F为Al,则C为氧化铝,B为氢氧化铝,E为偏铝酸钠;D为氯化铝;A溶液灼烧,焰色反应为浅紫色,A中含有K元素,则A为偏铝酸钾。
(1)分析可知,A为偏铝酸钾,化学式为KAlO2;C为氧化铝,化学式为Al2O3;D为氯化铝,化学式为AlCl3;E为偏铝酸钠,化学式为NaAlO2;
(2)①偏铝酸钾与过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钾,离子方程式为AlO2-+CO2+2H2O= Al(OH)3↓ + HCO3-;
②氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
③氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
④铝与氢氧化钠反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。