题目内容
【题目】按要求完成下列问题。
(1)写出下列物质在水溶液中的电离方程式:
H2SO4:___ Ba(OH)2:____
Al2(SO4)3:___ NaHSO4:______
NaHCO3:___
(2)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①用“双线桥法”标出下列氧化还原反应电子转移情况。___。
②还原剂是___,氧化产物是___。
③氧化剂与还原产物的物质的量之比为___。当生成2mol的NO2时,转移电子物质的量为___。
【答案】H2SO4=2H++SO42- Ba(OH)2=Ba2++2OH- Al2(SO4)3=2Al3++SO42- NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3- 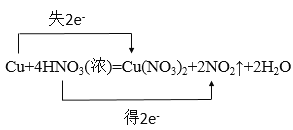 Cu Cu(NO3)2 1:1 2mol
Cu Cu(NO3)2 1:1 2mol
【解析】
(1)这些物质都是强电解质,它们的电离方程式为:
H2SO4=2H++SO42-;Ba(OH)2=Ba2++2OH-;Al2(SO4)3=2Al3++SO42-;NaHSO4=Na++H++SO42-;NaHCO3=Na++HCO3-;
(2)①该反应的电子转移方程式为: ;
;
②该反应中,Cu的化合价升高,HNO3中N的化合价降低,故Cu作还原剂,HNO3作氧化剂;
③该反应中,HNO3作氧化剂,还原产物为NO2,由于HNO3中部分起酸性的作用,部分起氧化剂的作用,根据化学方程式可知2分HNO3氧化Cu,生成2份NO2,故氧化剂与还原产物的物质的量之比为1:1;由于![]() →
→![]() 转移1个电子,故生成2mol的NO2,转移2mol电子。
转移1个电子,故生成2mol的NO2,转移2mol电子。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目